앞으로 품목허가받은 신의료기기는 신의료기술 평가를 거치지 않아도 곧바로 건강보험 급여 신청이 가능해진다.
보건복지부는 이같은 내용의 '국민건강보험 요양급여의 기준에 관한 규칙' 일부 개정안을 25일부터 입법예고한다.
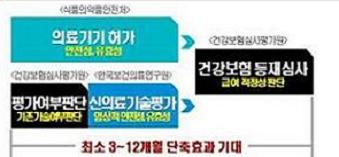
그동안 신의료기기는 일반적으로 1년 가량 한국보건의료연구원(보의연)의 신의료기술평가를 거쳐 안전성 및 유효성을 평가받은 뒤에 요양급여 신청을 할 수 있었다.
이번 개정은 지난해 12월 4차 무역투자활성화 대책의 후속 조치로, 신의료기기의 조기 시장 진입이 가능해졌다.
다만 복지부는 안전성을 보완하기 위해 임상 요건을 강화하고, 식약처 허가가 특정 사용 대상과 목적 등을 한정한 경우에 한해 신의료기술 평가를 면제할 방침이다. 아울러 안전성 위해요소 등이 있는 때에는 급여 절차 중이라도 직권으로 신의료기술 평가를 할 수 있도록 하기로 했다.
그러나 신의료기술 평가 면제에 따른 신의료기기의 유효성 및 안전성 논란이 제기되고 있다.
신의료기술 평가 제도는 효과없는 신의료기술로부터 국민건강을 보호하기 위해 의료기술(치료법, 검사법 등 의료행위)의 안전성과 효과성을 평가하는 제도로, 진단 키트 및 의료장비 등의 의료기기를 사용하는 의료행위도 포함되고 있다.
오지혜 기자
admin@medisobizanews.com

