[메디소비자뉴스=방석현 기자] 새해들어 국내제약사들의 임상시험이 암에 집중되고 있는 것으로 나타났다.
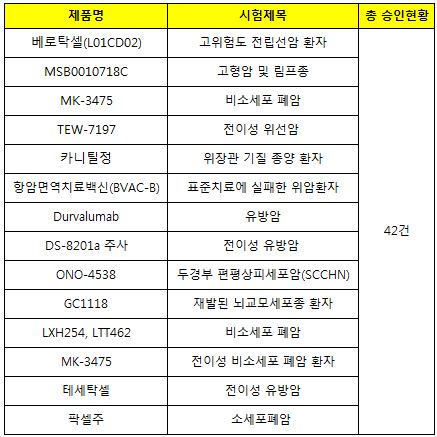
식품의약품안전처가 31일까지 1월 한 달 간의 임상 승인 현황에 따르면 총 임상 승인 42건 중 14건이 항암제 승인으로 집계됐다. <아래 표 참조>
이는 전체 승인 건수 가운데 33.3%를 차지했다. 2017년 29.5%, 2016년 26.5% 대비 증가세다.
주요 적응증으론 폐암과 유방암이 각각 4건, 3건으로 대부분을 차지했고, 이어 전립선암, 고형암, 위선암, 위장관기질종양, 위암, 두경부 편평상피세포암, 뇌교모세포종 등의 순이었다.
유방암, 비소세포폐암, 난소암 등의 적응증을 가진 종근당의 항암 주사제 ‘베로탁셀’(성분명 : 도세탁셀삼수화물)은 고위험도 전립선암 환자의 치료요법에 대한 임상을 승인받았다.
GC녹십자의 항암신약(GC1118)은 재발된 뇌교모세포종 환자의 치료를 위한 연구자임상을 승인받았다.
두경부암, 호지킨림프종에 적응증을 가진 MSD의 ‘키트루다’(성분명 : 펨브롤리주맙ㆍMK-3475)는 요로상피암(방광암)에 대한 적응증 추가 임상을 승인받았다.
아스트라제네카의 면역항암제 ‘임핀지’(두발루맙)는 유방암 적응증 추가를 위한 임상을 승인받았다.
오노약품ㆍBMS의 면역항암제 ‘옵디보’(니볼루맙ㆍONO-4538)는 두경부편평상피세포암에 대한 적응증 추가 임상을 승인받았다.
미국 바이오제약사인 젠타가 개발한 바이오 항암신약 ‘테세탁셀’은 유방암 적응증 확대를 위한 임상을 승인받았다. 이 약은 진행성 위암에 적응증을 갖고 있다.
이밖에 머크 ‘아벨루맙’(MSB0010718C), 바이오업체 메드팩토의 항암신약후보물질(TEW-7197), 한미약품의 뇌기능개선제 ‘카니틸정’ㆍ항암제 '팍셀주', 노바티스의 항암후보물질(LXH254) 등도 각각 임상을 승인받았다.
업계 관계자는 “암치료제는 전 세계적으로 시장 규모가 가장 크고 암종별 임상을 따로 진행해야 하는 특성이 있다"면서 "식약처의 항암제 임상 승인이 가장 많은 것은 국내제약사들이 항암제가 다른 치료제들보더 부가가치가 더 높아 개발에 중요성을 갖고 있음을 의미하는 것"이라고 말했다.