'파타놀점안액0.1%(올로파타딘염산염 단일제)'의 이상반응에 '눈물 분비 증가'가 추가됐다.
식품의약품안전처는 안과용제인 올로파타딘염산염 제제(전문의약품)에 대해 안전성 및 유효성 심사 등에 근거한 사용상 주의사항 등 허가사항 변경을 20일 사전 예고했다.
식약처는 이 약(1mg/mL 점안액)의 임상시험을 통해 안구와 연관된 증상으로 눈의 과도한 민감성 증가 등이 때때로 생길 수 있는 것으로 나타나 이상반응에 안과장애(눈물 분비 증가)를 신설했다고 설명했다.
또 이 약에 포함된 벤잘코늄염화물이 안구 자극을 일으킬 수 있어 콘택트렌즈가 착용된 채 투약돼선 안되며, 점적 후 적어도 15분 후에 콘택트렌즈를 착용토록 했다.
눈이 충혈됐을 때엔 콘택트렌즈를 착용치 않도록 권고됐다.
용법 및 용량과 관련해선 기존 1회 1방울 1일 2회 점안에 '필요시 최대 4개월 동안 치료할 수 있다'가 추가됐다.
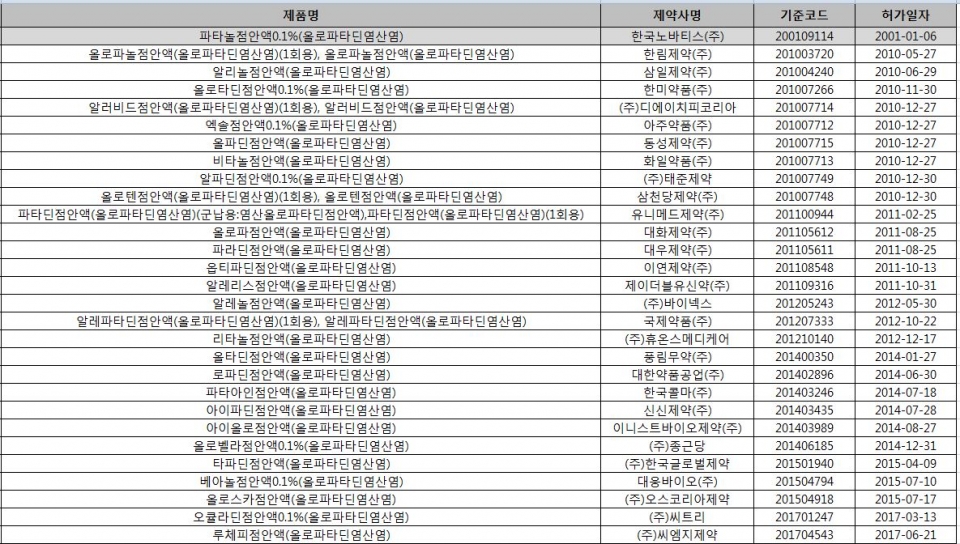
이 제제는 국내에서 파타놀점안액0.1%(노바티스), 알러비드점안액(디에이치피코리아), 엑솔점안액0.1%(아주약품), 알파딘점안액0.1%(태준제약) 등 34개 품목(29개 제약사)이 허가 및 판매되고 있다. <표 참조>
사전 예고 기간은 내년 1월4일까지이며, 내년 1월17일부터 변경될 예정이다.
오지혜 기자
admin@medisobizanews.com

