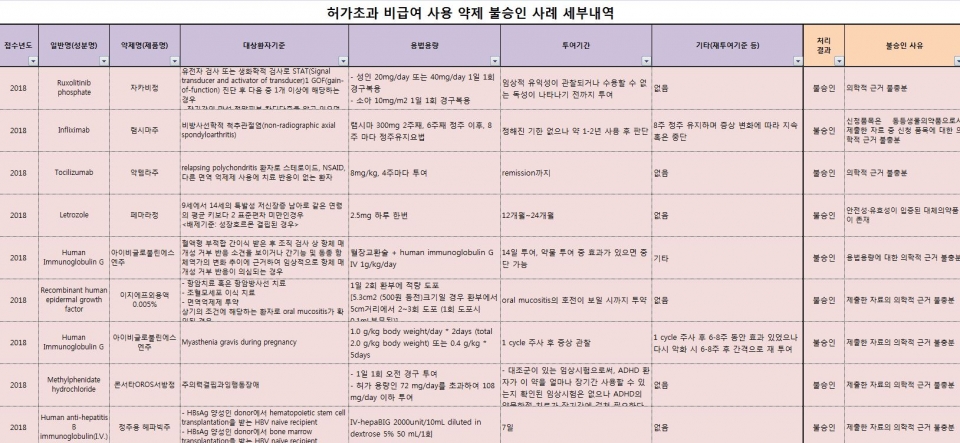
유방암치료제 '페마라'(노바티스) 등 9개 품목의 허가 초과 약제 비급여 사용이 불승인됐다. <표 참조>
건강보험심사평가원(이하 심평원)에 따르면 의학적 근거 부족 등으로 페마라, 골수섬유증치료제 '자카비'(화이자), 류마티스관절염치료제 '램시마'(셀트리온) 등이 허가 초과 약제와 관련해 승인이 불발됐다.
페마라는 9세에서 14세의 특발성 저신장증 남아로 같은 연령의 평균 키보다 2 표준편차 미만인 환자를 대상으로 검토한 결과, 안전성 및 효능이 입증된 대체제가 있는 까닭으로 불승인됐다.
자카비는 유전자 검사 또는 생화학적 검사로 STAT(Signal transducer and activator of transducer)1 GOF(gain-of-function) 진단 후 다음 중 1개 이상에 해당되는 환자에 대해 승인 신청됐지만, 의학적 근거 불충분으로 승인이 거부됐다.
램시마도 비방사선학적 척추관절염 사용과 관련해 의학적 근거 부족으로 불승인됐다.
이밖에 악템라, 아이비글로불린에스엔주, 이지에프외용액, 헤파빅, 콘서타 등도 의학적 근거 불충분으로 허가가 불발됐다.
이경숙 기자
admin@medisobizanews.com

