정신신경용제 '쿠에타핀정'(환인제약) 등 쿠에티아핀 제제의 '중증 피부 유해반응'에 대한 주의가 당부됐다.
식품의약품안전처는 유럽의약품청(EMA)의 쿠에티아핀 제제 관련 안전성 정보에 대한 검토 결과에 따라 이같이 허가사항 변경을 25일 지시했다.
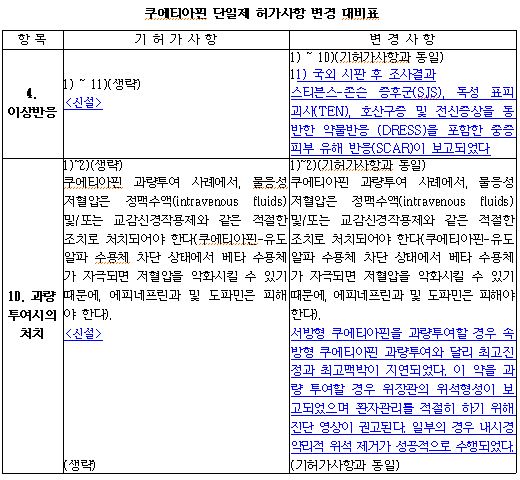
이 제제는 국외 시판 후 조사 결과, 스티븐스-존슨 증후군(SJS), 독성 표피 괴사(TEN), 호산구증 및 전신증상을 동반한 약물반응(DRESS)을 포함한 중증 피부 유해 반응(SCAR)이 보고됐다.
과량 투여시 처치 항목도 신설됐다.
서방형 쿠에티아핀을 과량 투여시 속방형 쿠에티아핀 과량 투여와 달리 최고 진정과 최고 맥박이 지연됐으며, 이 약을 과량 투여하면 위장관의 위석 형성이 보고됐다. <표 참조>
이 제제는 쿠에타핀정과 쿠에타핀서방정 등 환인제약의 품목이 11개로 가장 많고, 이들 품목을 포함해 92품목이 허가 및 판매되고 있다.
이 변경안에 대해 의견이 있으면 내달 9일까지 식약처(의약품안전평가과)에 제출하면 된다.
오지혜 기자
admin@medisobizanews.com

