혈당강하제 '나테글리니드' 제제 32개 품목의 허가 사항이 변경된다.
식품의약품안전처는 미국식품의약국(FDA)의 나테글리니드 함유 제제 관련 안전성 정보에 대한 검토 결과에 따라 20일까지 허가 사항 변경을 지시했다.
이 약은 주로 약물 대사 효소 CYP2C9(70%)와 CYP3A4(30%)로 대사되며 시험관 내 연구에서 톨부타미드의 대사 저해 능력 측정 시 생체 내에서 CYP2C9의 잠재적 저해제임이 밝혀졌다.
플루코나졸, 겜피브로질과 같은 좀더 강력한 CYP2C9 저해제와 병용 투여 시 주의가 당부됐다.
이런 허가 사항에 'CYP2C9 느린 대사자로 알려진 환자에게 투여할 때는 특별히 더 주의한다'가 추가됐다.
다만 CYP3A4에 따른 대사를 저해하는지에 대해선 밝혀진 바 없다.
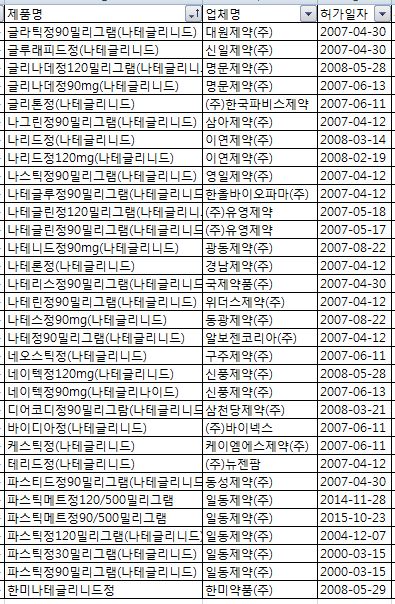
이 제제는 '글라틱정90mg'(대원제약), '글루래피드정'(신일제약), '글리톤정'(한국파비스제약) 등 32품목이 허가됐다. <표 참조>
박찬영 기자
asch123@hanmail.net

