식품의약품안전처는 '바이오식품첨가물 심사 규정'을 개정해 개발을 활성화하는 등 '식품첨가물의 기준 및 규격' 고시 일부 개정안을 10일 행정예고했다.
이번 개정안은 바이오기술의 발전으로 미생물을 이용한 다양한 바이오식품첨가물이 개발되고 있는 만큼 안전성 심사에 필요한 자료 제출 범위를 명확히 함으로써 영업자 편의를 높이는 한편 바이오식품첨가물 개발 활성화를 위해 마련됐다.
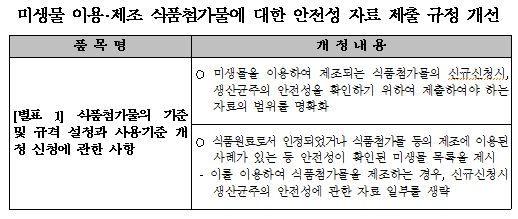
주요 내용은 ▲바이오식품첨가물 제조에 안전하게 사용할 수 있는 미생물 목록 신설 및 제조 미생물의 안전성 확인을 위한 제출 자료 명확화, 식품첨가물 직접 섭취 금지 조항 신설 등이 포함됐다.
식약처는 국제적으로 안전성이 입증돼 식품첨가물 제조에 널리 사용되고 있는 미생물 목록을 신설하고 해당 미생물로 제조된 식품첨가물에 대해선 해당 균주의 안전성 자료 일부를 면제토록 했다.
또 제조 미생물의 안전성 확인을 위해 제출해야 하는 자료의 종류를 명확히 규정, 민원인이 심사에 필요한 자료를 미리 예측할 수 있도록 했다고 식약처는 설명했다. <표 참조>
식약처는 앞으로도 식품의 안전성 확보와 식품산업의 활성화를 위해 식품첨가물 기준 및 규격을 합리적으로 개선할 계획이다.
한편 개정안에 대한 의견이 있으면 오는 9월9일까지 식약처(첨가물기준과)로 제출하면 된다.
오지혜 기자
admin@medisobizanews.com

