식품의약품안전처(처장 이의경)는 8월 14일~9월16일까지 콘택트렌즈, 전동식 모유착유기, 조직수복용생체재료(필러) 등 797업체 2515개 의료기기를 상대로 재평가 신청을 받는다고 11일 밝혔다.<표 참조>
‘의료기기 재평가’는 시판 후 수집된 안전성 정보 등을 바탕으로 제품의 안전성ㆍ유효성을 다시 확인하기 위한 조치다.
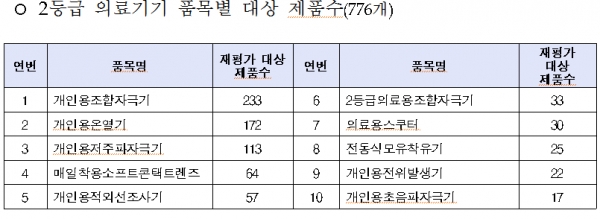
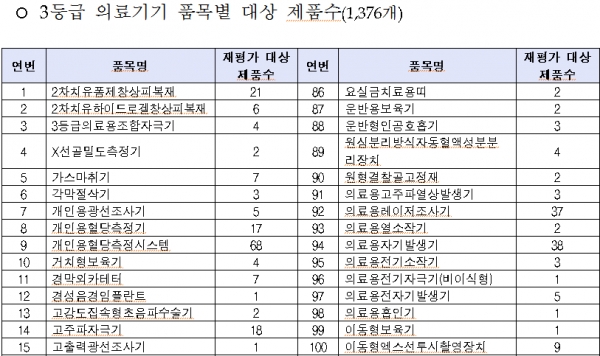
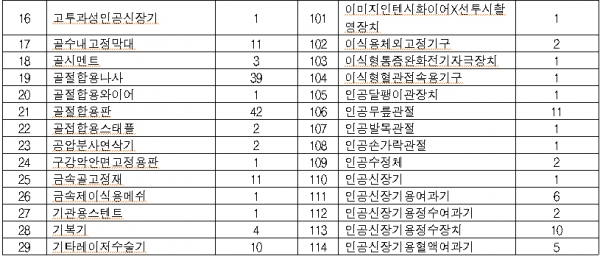
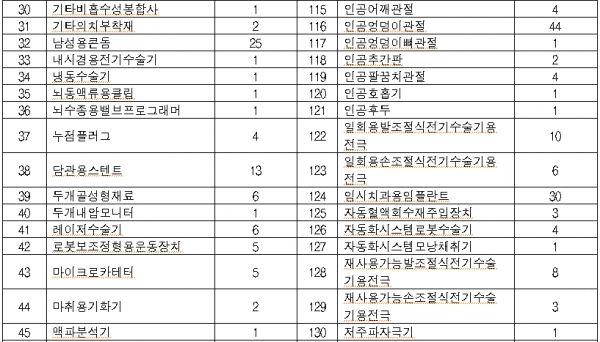
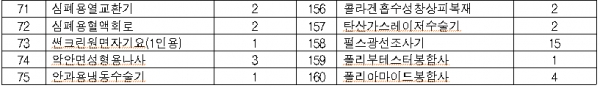
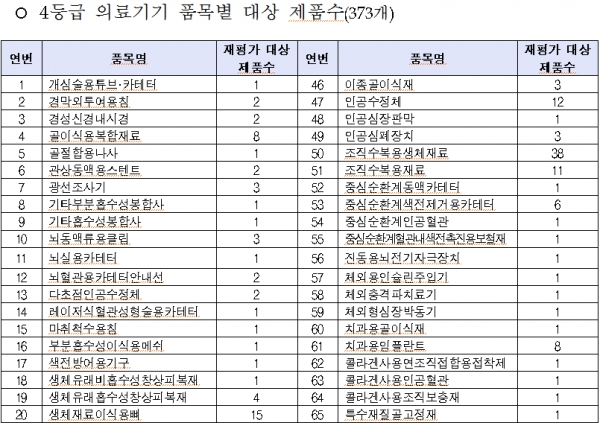
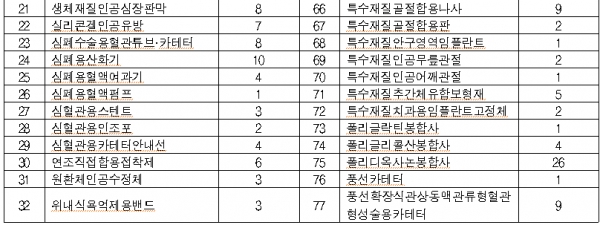
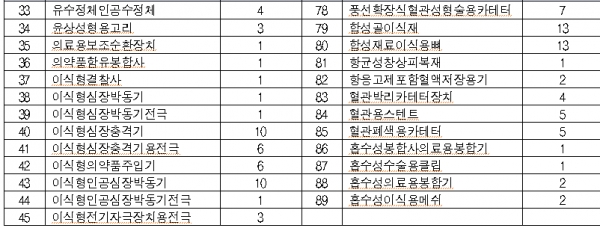
올 대상품목은 콘택트렌즈ㆍ전동식 모유착유기 등 일상생활서 많이 사용하는 2등급 의료기기 766개, 창상피복재ㆍ 치과용 임플란트 등 3등급 의료기기 1376개, 인공수정체ㆍ조직수복용 생체재료 등 4등급 의료기기 373개이다.
해당 업체들은 이 기간동안 의료기기 전자민원창구에 신청하면 된다.
신청기한 내 재평가 서류 제출을 하지않으면 해당 품목 판매업무 정지 등의 행정처분을 받는다.
1차 행정처분은 해당 제품 판매정지 2개월, 2차는 판매정지 6개월, 3차는 제조및 수입허가ㆍ인증 취소 또는 제조ㆍ수입 금지된다.
해당 업체는 허가일부터 현재까지 수집된 이상사례, 소비자 불만 사항, 국내외 학술논문 자료 등을 제출하면 식약처에서 제출 자료와 전문가 의견 등을 종합해 검토한다.
재평가 자료는 소비자 불만 및 요구사항, 이상사례와 부작용, 품질부적합, 제품 리콜(회수) 관련 사항이 포함된다.
자료에 안전성 정보도 포함해야 한다. 학술 논문, 임상자료 등 재평가 대상 제품과 관련된 새로운 정보사항을 작성해 제출해야 한다.
식약처는 "재평가 결과에 따라 제품의 사용 방법, 사용 시 주의사항 등 허가사항 변경과 품목허가 취소와 같은 필요한 조치를 취할 계획이며 앞으로도 의료기기 재평가를 통해 안전과 품질을 확보한 의료기기를 국민들에게 공급할 수 있도록 노력하겠다"고 밝혔다.
◇2019년 의료기기 재평가 대상 제품