항암제 '카보플라틴'과 '에피루비신' 이상반응에 패혈증과 폐렴이 잇따라 신설됐다.
식품의약품안전처는 항암 주사제인 카보플라틴과 에피루비신의 사용상 주의 사항 변경 등을 30일까지 의견 조회했다.
식약처는 시판 후 이상사례 보고 자료 분석 및 평가, 중앙약사심의위원회 자문 결과 등을 토대로 허가 사항을 새롭게 바꿀 방침이다.
이 허가 사항에 카보플라틴은 패혈증(감염), 에피루비신은 폐렴(호흡기계 부작용)이 각각 신규 반영된다.
이는 국내 시판 후 수집된 중대한 이상사례 분석 결과로, 다만 이들 성분과 이상사례 사이의 인과관계가 입증되지는 않았다고 식약처는 설명했다.
국내에선 이들 항암제는 모두 16품목이 허가됐다.
카보플라틴 제제는 화이자카보플라틴주10mg/ml(한국화이자), 카보틴주150밀리그람ㆍ카보틴주(대한뉴팜), 플라스틴주(구주제약), 알보젠카보플라틴주(알보젠코리아), 칸플라틴주(한국코러스), 카보티놀주사(한국유나이티드제약), 동아카프란주사액(동아에스티), 네오플라틴주(보령제약)의 9품목(수출용 포함)이다. <표1 참조>

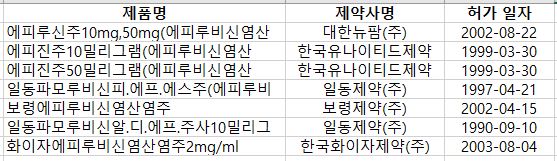
에피루비신 제제는 화이자에피루비신염산염주2mg/ml(한국화이자), 에피루신주10ㆍ50mg(대한뉴팜), 에피진주10ㆍ50밀리그램(한국유나이티드제약), 일동파모루비신피.에프.에스주(일동제약), 보령에피루비신염산염주(보령제약) 등 7품목이다. <표2 참조>
김영우 기자
admin@medisobizanews.com

