식품의약품안전처는 국제의료기기규제당국자포럼(IMDRF)에서 운영하는 '의료기기단일심사프로그램(MDSAP)'의 참여 기반을 마련했다고 23일 밝혔다.
식약처는 MDSAP의 첫 번째 협력 회원으로 GMP 제도를 개선할 수 있다고 설명했다.
IMDRF(International Medical Device Regulators Forum)는 의료기기 규제 조화를 위해 설립된 규제당국자 협의체로 미국, 유럽, 대한민국 등 10개국으로 구성됐다.
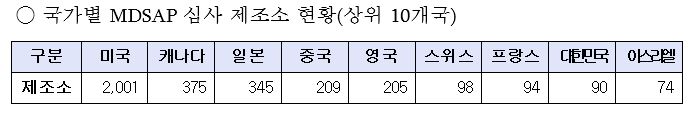
MDSAP(Medical Device Single Audit Program)는 IMDRF에서 의료기기 안전과 품질관리를 위해 국제 기준에 따른 공동 심사를 목적으로 만든 인증제로, 미국과 캐나다, 호주, 브라질, 일본 5개국이 정식 회원으로 공동 운영되고 있다. <표 참조>
협력 회원은 정식 참여를 위한 준비 단계로 의료기기단일심사프로그램 운영 현황, 심사 결과 등의 정보를 공유받을 수 있다.
이번 협력 회원 참여로 우리나라가 정식 회원으로 가입할 수 있는 유리한 위치를 선점하였다고 평가됐다.
식약처는 정식 회원이 되면 회원국 간 의료기기 GMP 평가 결과가 상호 인정돼 GMP 심사 비용 및 시간 절감, 국제 수준의 의료기기 품질관리 등 국내 의료기기 수출활성화에 크게 도움이 될 것으로 기대하고 있다.
이번 계기를 발판으로 식약처는 ▲국제 기준과 조화될 수 있도록 GMP 심사 제도 개선 ▲의료기기단일심사프로그램에서 발간한 130여개 심사 가이드라인의 한국어판 발간 ▲의료기기단일심사프로그램 규제당국자 초청 세미나 개최 등 국내 제조업체가 의료기기단일심사프로그램 도입에 대해 준비할 수 있도록 지원할 계획이다.

