작년에 미국 FDA에서 승인을 받은 제네릭의 70%가 특허 장벽으로 인해 판매되지 못하는 것으로 나타났다.
월스트리트 저널(Wall Street Journal)의 최근 보고서에 따르면 2016~2018년 사이에 승인된 제네릭의 3분의 2만 판매되고 있고 ‘승인 풍년’을 맞은 작년의 경우에는 30% 미만만 제품이 출시됐다.
이 보고서는 아이큐비아 자료를 인용하면서 2016년부터 현재까지 FDA 승인을 받은 제네릭은 617개 제약사 2492개 품목이지만 1249개만 출시됐다고 밝혔다. 올해의 경우 6월까지 승인된 442개 제네릭 의약품 중 134개만 시판되고 있다고 말했다. 출시를 못하고 있는 제품은 항암제와 류마티스 관절염 치료제 같은 의약품과 매년 수십만 달러에 이르는 바이오 약품이 특허 장벽에 막혀있다고 보고서는 덧붙였다.
제네릭 출시의 좁은 문과 달리 오리지널 약값은 계속 오르고 있는 것으로 밝혀졌다.
올 상반기 오리지널 의약품은 평균 5% 인상했다. 이는 예년 평균 9% 인상에는 못 미치지만 미국 정부와 의회의 제네릭 우대 정책에도 불구하고 약값 상승의 추세는 이어지고 있다.
또 일부 제품은 제네릭에 대한 인식 부족과 보험사 기피로 시판 후에도 고전을 겪고 있다. 올해 5월에 릴리는 인슐린 ‘휴마로그(Humalog)'의 반값 제네릭 버전인 ‘리스프로(lispro)'를 발매했지만 인식 부족 등으로 일부 보험에 등재 되지 못하며 고전하고 있다.
바이오시밀러는 더 좁은 문이다.
2015년 첫 바이오시밀러 승인 후 현재까지 25개 약물이 FDA 승인을 받았지만 11개만 시판되고 있다. 예를 들어 화이자의 ‘아브릴라다’가 최근 승인을 받아 ‘휴미라’ 바이오시밀러는 5개로 늘어났다.
현재까지 FDA 승인을 획득한 휴미라 바이오시밀러는 아브릴라다를 비롯해 암젠의 '암제비타(Amjevita)', 베링거인겔하임 '실테조(Cyltezo)', 산도스 '하이리모즈(Hyrimoz)', 삼성바이오에피스 '하드리마(Hadlimaㆍ유럽 제품명 ‘임랄디’)'가 있다. 오리지널 제약사인 애브비와 특허 소송을 벌인 제약사는 8곳으로 승인된 5개 외에 나머지 3개 약물은 아직 승인되지 않은 상황이다. 애브비와 소송 합의를 통해 내년 1월에 발매되는 '암제비타'를 필두로 하드리마, 실테조, 하이리모즈, 아브릴라다 순으로 시판될 예정이다.
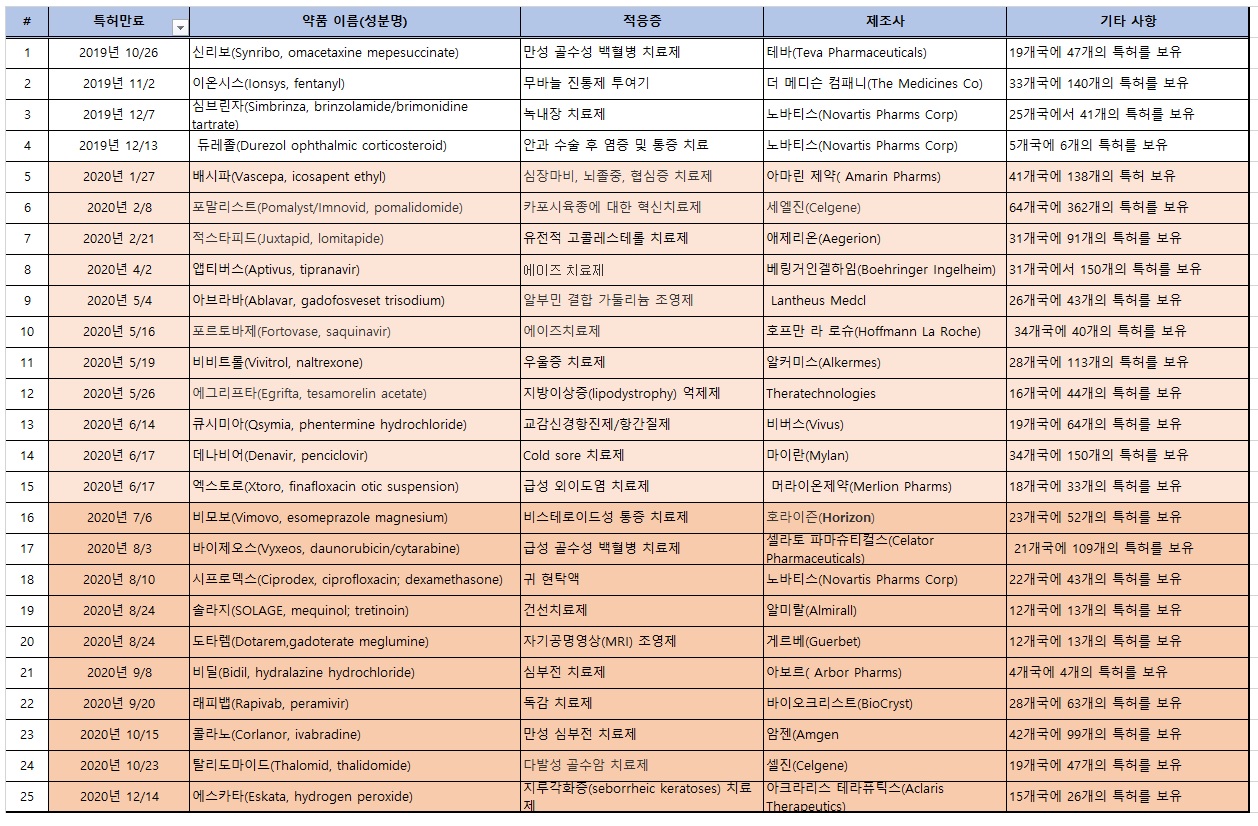
<주요 의약품 미국 특허 만료일>