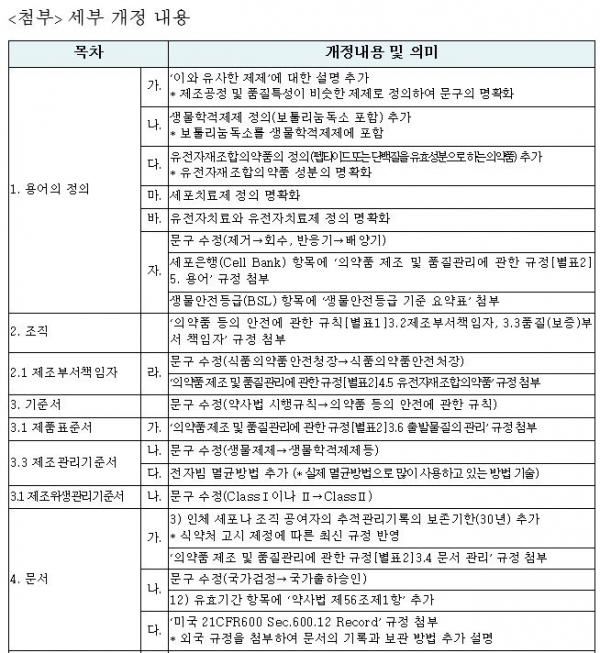
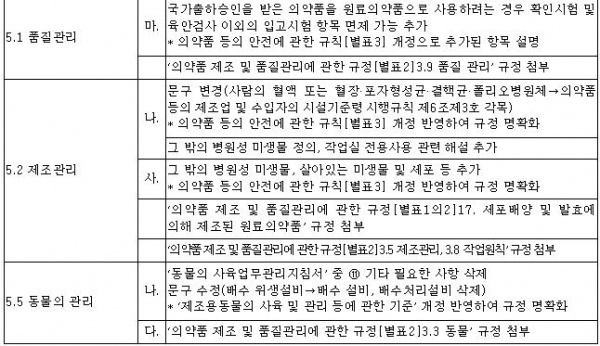
식품의약품안전처는 생물학적 제제, 세포치료제 등 바이오의약품 제조ㆍ품질관리기준(GMP) 업무 이해에 도움을 주기 위해 '바이오의약품 GMP 해설서'를 29일 개정 및 발간했다. <표 참조>
개정 주요 내용은 생물학적 제제, 세포치료제, 유전자치료제의 정의 설명과 함께 병원체 종류별 전용 작업실에 대해 추가 설명 등으로 현장에서 유용하게 사용할 수 있도록 마련됐다.
이번 해설서는 바이오의약품 GMP 관련 규정의 '의약품 등 안전에 관한 규칙' 생물학적 제제 등 제조 및 품질관리기준(2013년 제정), '의약품 제조 및 품질관리에 관한 규정' 생물유래의약품의 원료 및 완제의약품의 제조(2015년 제정)에 관한 개정 사항을 반영하고, 미국 규정인 '21 CFR(미국 연방 규정집) 600 Sec.600.12 Record'를 참고 사항으로 제시해 이해를 도왔다고 식약처는 설명했다.
식약처는 이번 해설서 개정으로 관련 업계에서 바이오의약품 GMP 기준을 명확하게 이해, 안전과 품질이 확보된 바이오약품을 만들고, 정부와 업계의 눈높이를 맞춰 제도 운영의 투명성이 강화될 것으로 전망했다.
오지혜 기자
admin@medisobizanews.com

