아스트라제네카(AZ)와 다이이찌산쿄가 공동 개발 중인 항체-약물결합체(ADC) 신약 '트라스투주맙 데룩스테칸(Trastuzumab deruxtecan)'이 전이성 유방암 환자의 질병 진행을 중단시킬 수 있는 것으로 나타나 두 회사의 내년 최고 기대주로 떠올랐다.
아스트라제네카와 다이이찌산쿄는 11일(현지시간) 미국 샌안토니오 유방암 심포지엄(2019 San Antonio Breast Cancer Symposium)에서 글로벌 임상 2상(DESTINY-Breast01) 시험 결과를 발표했다.
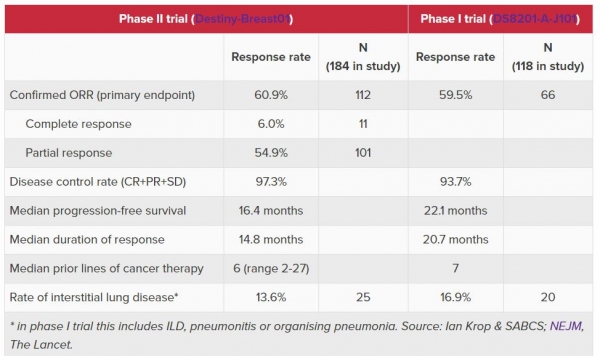
이전에 2가지 이상의 HER2 표적 요법을 받은 HER2 양성 전이성 유방암 환자를 대상으로 한 글로벌 2상에서 트라스투주맙 데룩스테칸 단독요법 치료 후 확인된 객관적 반응률(ORR)은 60.9%로 입증됐다. 환자들은 전이성 질환에 대해 로슈의 ADC ‘카드실라’(Kadcyla)를 포함해 평균 6가지 치료를 받은 상태였다.
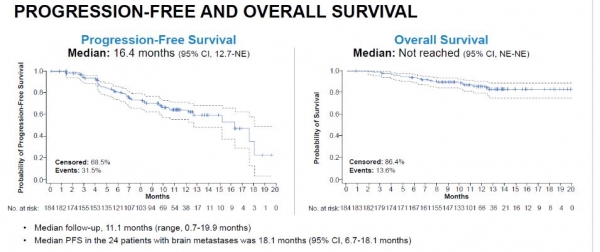
질병조절률(DCR)은 97.3%, 반응 지속기간(DoR) 중앙값은 14.8개월, 무진행 생존 기간(PFS) 중앙값은 16.4개월로 나타났다.
다나파버암연구소(Dana-Farber Cancer Institute)의 이안 크롭 박사는 "16개월 무진행 생존율과 60%의 객관적 반응률은 일반적인 다른 임상의 약 2배 또는 3배"라고 말했다. 전체 생존 기간(OS)은 아직 중앙값에 도달하지 않았지만 1년 생존율은 86%로 집계됐다.
안전성과 내약성 프로파일은 임상 1상 시험에서 관찰된 것과 일관됐다. Grade 3 이상 치료 후 가장 흔한 이상반응은 호중구 수 감소, 빈혈, 구역, 백혈구 수 감소, 림프구 수 감소, 피로 등이 보고됐다.
다만 트라스투주맙 데룩스테칸 단독요법의 아킬레스건은 간질성 폐질환 부작용으로 지적됐다. 임상 환자의 13.6%에서 나타났고 그 중 4명은 합병증으로 사망했으며 치료 사망으로 간주됐다. 임상 1상보다는 약간 개선됐지만 여전히 큰 단점으로 남아있다.
임상을 주도한 크롭 박사도 '허셉틴'(Herceptin)과 카드실라를 포함한 다른 약물의 연구에서 볼 수 있는 것보다 간질성 폐질환의 발생률이 더 높다고 인정했다.
미국 FDA는 최근 트라스투주맙 데룩스테칸 판매 허가 신청을 접수하고 우선 심사키로 한 상태다. 승인 여부는 내년 2분기에 결정된다.