항암제 '독소루비신'과 혈전용해제 '유로키나제'의 주사제 2종에 대한 투약 주의(안전성 경고)가 당부됐다.
식품의약품안전처는 독소루비신주와 유로키나제주에 대한 국내외 허가 사항 및 안전성 등 정보를 검토한 결과, 사용상 주의 사항 등 허가 사항 변경을 18일 잇따라 지시했다.
독소루비신은 '상호작용'과 연관돼 항암제인 트라스투주맙 투약 중단 후 7개월까지 트라스투주맙이 순환계에 존재할 수 있어 심장 관련 안전성이 경고됐다.
트라스투주맙 투여 중지 후 안트라싸이클린계 약물이 투약된 환자에게서 심기능 장애가 증가될 수 있어 가능하다면 트라스투주맙 투여 중단일로부터 7개월까지 안트라싸이클린계 약물이 포함된 요법을 피하도록 해야 하며, 안트라싸이클린계 약물을 투여하는 경우 심장기능을 주의깊게 모니터해야 한다고 식약처는 설명했다.
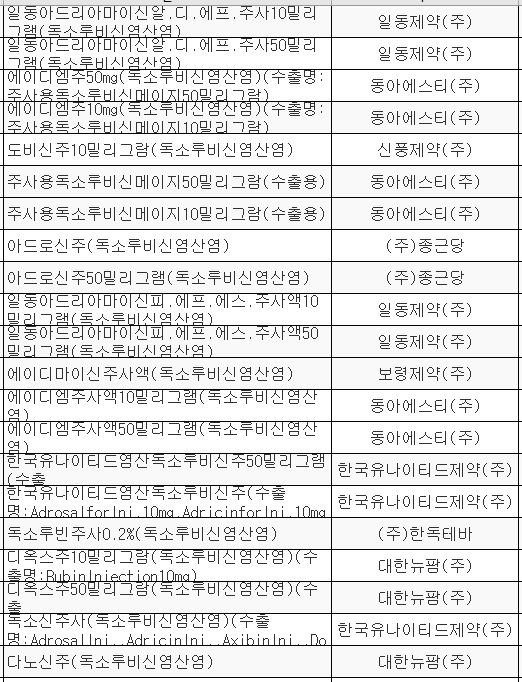
독소루비신 제제는 독소루빈주사0.2%(한독테바), 디옥스주(대한뉴팜), 독소루신주(한국코러스), 유니온염산독소루비신주(한국유니온제약), 독소신주사(한국유나이티드제약), 에이디마이신주사액(보령제약), 에이디엠주사액(동아에스티), 일동아드리아마이신알.디.에프(일동제약), 도비신주(신풍제약), 아드로신주(종근당) 등 25개 품목(수출용 포함)이 허가됐다. <표 참조>
유로키나제도 사용상 주의 사항에 뇌색전증 또는 그 의심 환자(출혈성 뇌경색 유발 가능)가 신설됐다. 이 제제는 녹십자유로키나제주500,000단위(수출 품목 메디나제 포함) 등 GC녹십자 5품목이 해당된다.
이 두 주사제의 허가 사항은 내달 중 변경될 예정이다.