항암제 '맙테라주'(로슈)와 결핵치료제 '서튜러정'(얀센) 등 약제가 허가 초과 비급여 사용이 불발됐다. <표 참조>
건강보험심사평가원은 맙테라와 서튜러, 항암제 '트룩시마'(셀트리온)에 대해 의학적 근거 부족으로 허가 초과 약제 비급여 사용을 4일 불승인했다.
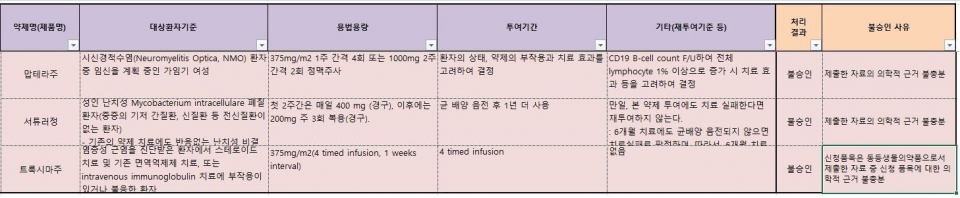
심사평가원에 따르면 맙테라는 시신경척수염(Neuromyelitis OpticaㆍNMO) 환자 중 임신을 계획 중인 가임기 여성을 대상으로 375mg/m² 1주 간격 4회 또는 1000mg 2주 간격 2회 정맥주사 투여로 비급여 사용이 신청됐지만, 제출한 자료의 의학적 근거 불충분으로 사용이 불발됐다.
서튜러도 성인 난치성 마이코박테리움(결핵균ㆍMycobacterium intracellulare) 연관 폐질환자(중증의 기저 간질환 및 신질환 등 전신질환이 없는 환자 - 기존 치료제에도 반응없는 난치성 비결핵항산균(NTM)이고 악화 중인 폐질환자로서 해당 약제(bedaquiline) 사용 병력이 없는 환자)에게 첫 2주간 매일 400mg 투약한 뒤 200mg 주 3회 투여에 대해 신청됐지만 불발됐다. 심사평가원은 제출한 자료의 의학적 근거 불충분으로 비급여 사용을 불허했다.
맙테라의 바이오시밀러인 트룩시마는 염증성 근염으로 진단된 환자에게서 스테로이드 및 면역억제제 치료 또는 면역글로불린 제제 치료에 부작용이 있거나, 불응한 환자를 대상으로 1주 간격으로 375mg/m² 4회 정맥주사가 비급여 사용으로 신청됐지만 불승인됐다.
심사평가원은 트룩시마가 동등생물의약품으로 제출한 자료 중 신청 품목에 대한 의학적 근거 불충분으로 심의했다.
이번 불승인 사례 3건이 추가되며 총 173건으로 증가됐다.
심사평가원은 의학적 근거가 부족하거나 안전성이 우려되는 약제 사용의 사전 예방으로 안전한 의약품 사용을 도모하고, 국민과 의료기관의 알 권리 및 편의 증대를 위해 불승인 사례를 2013년부터 공개하고 있다.