생산ㆍ수입ㆍ공급 중단 의약품에 대해 약품안전사용정보시스템(DUR)에서 점검이 가능해졌다. <표 참조>
보건복지부는 DUR과 관련해 환자 안전 및 의약품 관리의 효율성 등을 높이기 위해 '생산ㆍ수입ㆍ공급 중단 의약품' 점검 항목을 신설하는 등 '의약품 정보 확인 및 정보시스템 운영 등에 관한 지침'을 27일 개정했다.
주요 내용은 이 항목의 신설과 함께 '효능군 중복 의약품' 세부 적용 기준 변경 및 기준 명확화, 표준 팝업창 예시 화면 최신화<그림 참조>, 처방 및 조제 사유 코드 정비 등이다.
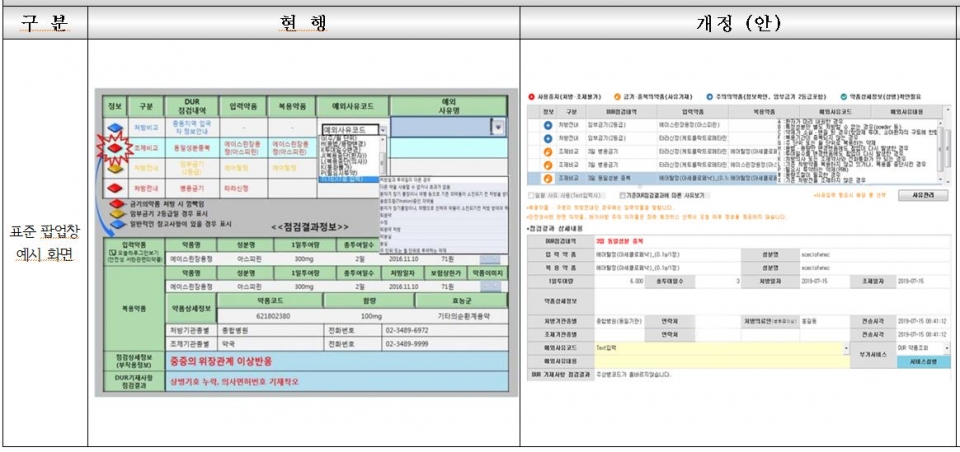
특히 이번 개정은 생산ㆍ수입ㆍ공급 중단 의약품에 대해 DUR에서 점검함으로써 원활한 조제 및 투약 서비스를 제공하기 위한 것으로 의ㆍ약 단체 요구가 수용된 것이다.
이와 연관돼 식품의약품안전처장이 공개한 생산ㆍ수입ㆍ공급 중단 의약품에 대해 처방전 내 점검되고, 동일 품목 허가(신고) 제품의 모든 포장 단위의 공급 중단된 의약품이 대상으로 돼있다.
효능군 중복 약품 복합제 점검을 위한 기준도 추가됐다. 단일제 및 복합제(3개 성분 이내)에 대해선 개별 성분이 각각 점검된다. 다만 마약류 약품(향정약 포함)을 뺀 약이 1~2일 효능군 중복 시 예외 사유 기재가 생략된다.
투여 기간 주의 의약품(최대 투여 기간), 분할 주의 의약품, 비용효과적인 함량 사용 대상 의약품에 대해서도 용어 수정 포함 세부 적용 기준이 변경됐다.
또 구분 용어 명시 및 정확한 사유 기재 유도를 위한 사유 구분 명확화와 아울러 사유 코드는 조영제 투약 관련 병용금기(처방전 간)에만 해당된다.


