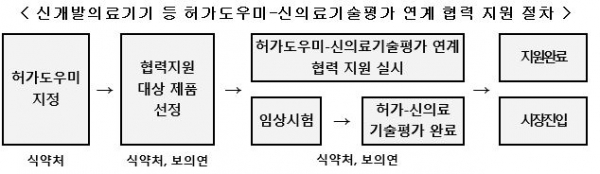
식품의약품안전처(처장 이의경)와 한국보건의료연구원(이하 보의연ㆍ원장 한광협)은 신개발 의료기기의 신속한 시장 진입 지원 체계 구축을 위해 식약처의 허가 도우미와 보의연의 신의료기술평가를 시범 연계 운영한다고 27일 밝혔다. <그림 참조>
이 지원 사업은 허가 도우미로 지정된 3개 부문에 대해 이날부터 시행되며, ▲허가 단계부터 신의료기술평가를 고려한 임상 설계 ▲개발 제품 사용 목적 구체화 ▲제조 및 품질관리시스템(GMP) 검토 ▲안전성 및 성능 검토 등 전주기 컨설팅이 진행된다.
3개 부문은 손상된 각막을 대체하기 위한 인공각막, 암치료를 위한 치료용중성자조사장치, 증강현실(AR)을 이용해 시술할 병변의 위치를 표시하는 기기를 말한다.
특히 ‘임상시험 설계 자문’을 통해 허가를 위한 임상 계획 설계 단계에서 신의료기술평가를 동시에 고려할 수 있어, 신의료기술평가 때 안전성과 유효성 연구 결과의 미흡으로 시장 진입이 어려워지는 것을 해소할 수 있을 것으로 예상된다.
그간 기술력은 있지만, 영세한 업체는 전문인력이나 정보 부족으로 신의료기술 등재를 거쳐 시장 진입하는 데 어려움을 겪었던 것으로 지적되고 있다.
식약처와 보의연은 이번 협력 사업으로 신개발 의료기기의 시장 진입 기회가 확대될 것으로 전망했다.
오지혜 기자
admin@medisobizanews.com

