당뇨병치료제인 알로글립틴 제제(단일ㆍ복합제) 이상반응에 근골격계 장애ㆍ폐렴 등이 신설됐다. <표 참조>
식품의약품안전처는 알로글립틴 단일ㆍ복합제와 알로글립틴+메트포르민 제제에 대한 재심사 결과에 따라 이같이 허가 사항 변경 지시안을 27일 마련했다.
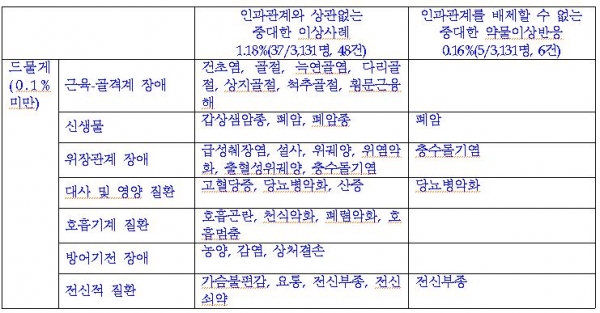
알로글립틴은 국내에서 재심사를 위해 6년간 3131명을 대상으로 실시한 시판 후 조사 결과, 이상사례의 발현율은 인과관계와 상관없이 9.71%(304명/3131명ㆍ총 414건)로 보고됐다.
이 중 인과관계와 상관없는 중대한 이상사례 및 인과관계를 배제할 수 없는 중대한 약물이상반응은 발현 빈도에 따라 근육-골격계 및 위장관계 장애, 대사질환, 암(폐암 포함) 등이 나타났다고 식약처는 설명했다.
알로글립틴+메트포르민 제제는 6년 동안 538명을 대상으로 실시한 시판 후 조사 결과, 이상사례의 발현율은 인과관계와 상관없이 6.51%(35명/538명ㆍ총 40건)로 보고됐다.
이 중 인과관계와 상관없는 중대한 이상사례는 때때로(0.1~5%미만) 호흡기계 질환(폐렴)이 발생해 주의가 당부됐다.
이 제제는 모두 다케다제약의 10품목이 국내 허가됐다. 알로글립틴 단일제는 네시나정12.5ㆍ25ㆍ6.25mg, 알로글립틴 복합제(피오글리타존 병용)는 네시나액트정12.5/15ㆍ12.5/30ㆍ25/15ㆍ25/30mg이 해당됐다.
알로글립틴ㆍ메트포르민 복합제론 네시나메트정12.5/1000ㆍ12.5/500ㆍ12.5/850mg이 각각 허가를 받았다.
한편 이 변경안에 대한 의견서는 내달 9일까지 식약처(의약품안전평가과)에 제출하면 된다.