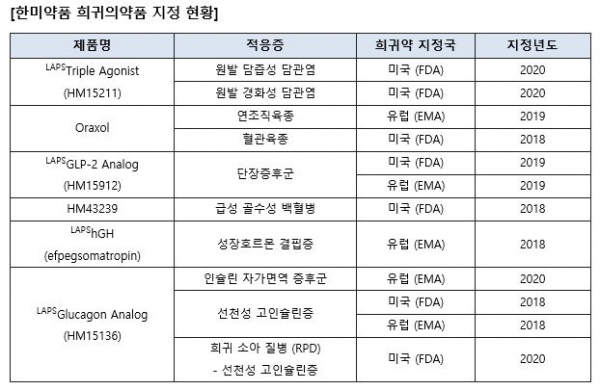
한미약품(대표이사 권세창ㆍ우종수)은 자사가 바이오신약으로 개발 중인 후보물질(혁신신약 후보물질) '랩스글루카곤 아날로그(LAPSGlucagon Analogㆍ코드명 : HM15136)에 대해 미식품의약국(FDA)이 지난 24일 소아에게서 발생하는 선천성 고인슐린증 치료를 위한 희귀의약품으로 지정했다고 26일 밝혔다.
HM15136은 미국 FDA로부터 희귀 소아 질병 의약품(Rare Pediatric DiseaseㆍRPD)으로 지정된 것이다.
RPD는 희귀 소아질환을 예방 또는 치료하는 신약 후보물질의 개발을 장려하고자 제정된 FDA 특수 프로그램이다. RPD 지정을 받은 적응증으로 해당 신약 후보물질의 허가를 받으면 추후 사용할 수 있는 '우선심사권(Priority Review VoucherㆍPRV)'이 제공된다.
PRV는 FDA의 허가심사를 6개월 안에 완료할 수 있도록 해주는 권리로, 다른 제품의 시판 허가 절차에서 유용하게 사용할 수 있고, 회사 간 PRV 판매 및 양도도 가능하다. HM15136은 2018년 FDA로부터 ODD(Orphan Drug Designation : 희귀의약품 지정)로 승인된 데 이어 이번에 추가로 RPD로도 지정됨에 따라, 앞으로 한미약품의 혁신신약 후보물질이 FDA의 의약품 신속 개발 특수 프로그램 적용을 받을 가능성이 높아졌다는 게 이 회사의 설명이다.
선천성 고인슐린증은 신생아와 소아에게 심각하고 지속적인 저혈당을 일으키는 희귀질환으로, 신생아 2만5000~5만명당 1명꼴로 생기며, 이 중 60% 가량이 생후 1개월 안에 진단을 받는 것으로 알려졌다.
현재까지 해당 질환으로 허가받은 치료제가 없어 다수의 신생아와 소아들은 조기 진단에도 불구하고 off-label(의약품 허가 외) 처방 등 불충분한 치료만 받을 수 있어 심각한 저혈당에 따른 뇌손상 위험이 큰 상황인 것으로 지적되고 있다.
회사에 따르면 HM15136은 체내 포도당 합성을 촉진하는 글루카곤의 짧은 반감기와 생체 유사 환경에서의 부족한 용해도 및 안정성을 획기적으로 개선한 세계 최초의 주 1회 투여 글루카곤 후보물질로, 선천성 고인슐린증 등 만성 저혈당 질환을 앓고 있는 유ㆍ소아 환자들의 삶의 질을 개선할 수 있을 것으로 기대되고 있다.
HM15136은 현재 미국에서 비만 적응증으로 임상 1상이 진행되고 있으며, 유럽 EMA로부터 선천성 고인슐린증(2018년) 및 인슐린 자가면역 증후군(2020년) 치료를 위한 희귀의약품으로 지정된 바 있다. <표 참조>
이 회사 권세창 사장은 "현재 자사가 개발 중인 혁신신약 파이프라인들은 FDA와 EMA로부터 12건의 희귀약 지정을 받았다"며 "지속적 연구개발을 통해 희귀질환으로 고통받는 유ㆍ소아를 비롯한 전 세계 환자들의 삶의 질을 높이는 데 기여할 것"이라고 강조했다.