삼성바이오에피스(대표 고한승 사장)는 26일(현지시간) 유럽의약품청(EMA) 약물사용 자문위원회(CHMP)로부터 항암제로 아바스틴 바이오시밀러인 '에이빈시오'(프로젝트명 SB8ㆍ성분명 베바시주맙)가 긍정 의견(positive opinion)을 받아 허가에 청신호가 켜졌다고 27일 밝혔다.
이는 지난해 7월 EMA의 허가심사가 시작된지 약 11개월 만에 자문위원회의 긍정 의견을 받은 것으로, 통상 2~3개월 소요되는 유럽연합집행위원회(EC)의 최종 검토를 거쳐 공식 판매 허가를 얻을 수 있을 것으로 기대된다.
에이빈시오의 오리지널 의약품 아바스틴은 스위스 로슈(Roche)가 판매 중인 종양질환 치료제로, 유럽에서 전이성 대장암, 비소세포폐암, 전이성 유방암 등의 적응증을 갖고 있다. 아바스틴의 지난해 글로벌 시장 매출은 총 70억7300만 스위스프랑(약 8조5000억원)에 달하며, 그 중 유럽 시장에서의 매출은 17억9400만 스위스프랑(약 2조2000억원)을 기록했다. 유럽 매출이 4분의 1을 차지한다.
삼성바이오에피스 고한승 사장은 에이빈시오의 유럽 CHMP의 긍정 의견과 관련해 "글로벌 시장에서 자사의 연구개발 역량을 다시 한번 입증했으며, 고품질 바이오의약품을 통한 암 환자들의 치료 혜택을 더욱 확대할 수 있는 가능성을 열었다"고 말했다.
회사에 따르면 삼성바이오에피스는 현재 유럽에서 류마티스관절염 등의 자가면역질환 치료제인 베네팔리(엔브렐 바이오시밀러), 임랄디(휴미라 바이오시밀러), 플릭사비(레미케이드 바이오시밀러)와 유방암 등의 종양질환 치료제 온트루잔트(허셉틴 바이오시밀러)를 판매하고 있다. <표 참조>
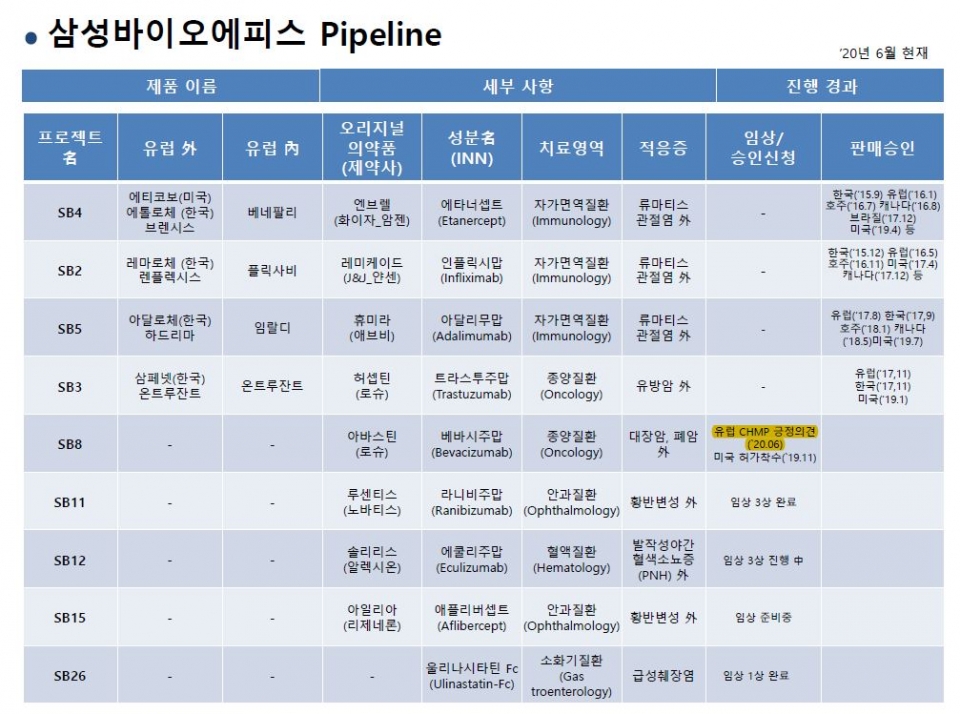
에이빈시오는 삼성바이오에피스가 선보이는 다섯 번째 바이오시밀러 제품이자 두 번째 종양질환 치료제로, 지난해 11월엔 미식품의약국(FDA)에서도 허가심사가 시작되는 등 글로벌 시장 진출이 더욱 가시화되고 있다고 이 회사는 설명했다.
한편 삼성바이오에피스는 지난해 9월 스페인 바르셀로나에서 열린 유럽종양학회 정기 학술대회(ESMO cogress 2019)에서 에이빈시오(SB8)의 임상 3상 결과를 발표, 비소세포폐암(NSCLC) 환자 총 763명을 대상으로 한 연구 결과를 통해 오리지널 의약품 대비 리스크 반응 비율(risk ratio of best ORR2) 측면의 동등성을 입증한 바 있다.

