한미약품(대표이사 권세창ㆍ우종수)은 단장증후군 치료 바이오신약으로 독자 개발 중인 'LAPSGLP-2 Analog(코드명 : HM15912)'가 미국 FDA로부터 희귀 소아 질병 의약품(Rare Pediatric Disease DesignationㆍRPD)으로 지정(추가 지정)됐다고 30일 밝혔다.
이는 지난 24일 RPD로 지정된 'LAPSGlucagon Analog(선천성 고인슐린증 치료 바이오신약)'에 이어 두 번째다. 이 회사는 이같이 RPD 연속 지정에 따라 30여개에 이르는 자사 혁신신약 파이프라인들이 희귀질환 분야에서 혁신성을 확고히 입증받게 됐다고 설명했다. <표 참조>
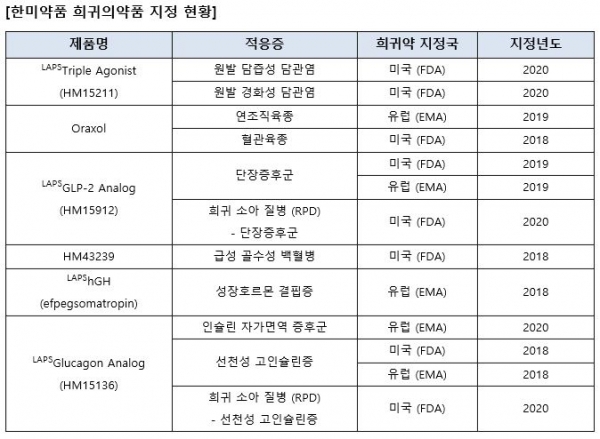
한미약품은 HM15912에 대해 LAPSGLP-2 Analog의 개선된 체내 지속성 및 융모세포 성장 촉진 효과를 바탕으로 월 1회 투여를 목표로 개발 중이다. 이 회사는 이를 통해 단장증후군을 앓고 있는 소아 및 성인 환자들의 삶의 질을 획기적으로 개선할 수 있을 것으로 기대하고 있다.
이 회사는 현재 단장증후군을 적응증으로 LAPSGLP-2 Analog의 국내 임상 1상을 진행 중이며, 올 하반기 미국과 유럽에서 각각 임상 2상을 시작할 계획이다. LAPSGLP-2 Analog는 작년 미국 FDA와 유럽 EMA로부터 단장증후군 치료 희귀의약품으로 지정된 바 있다.
이 회사 권세창 사장은 "자체 개발 플랫폼 기술 '랩스커버리'가 적용된 파이프라인 등으로 희귀약 지정을 받은 사례가 13건에 달하는 등 이 분야에서의 혁신성을 지속적으로 입증해 나가고 있다"며 "계속적인 연구개발 및 적응증 확대를 통해 희귀질환으로 고통받는 유ㆍ소아를 비롯한 전 세계 환자들의 삶의 질을 획기적으로 높일 수 있도록 최선을 다할 것"이라고 강조했다.
<용어 설명>
1. 단장증후군(Short bowel syndrome) : 선천성 또는 생후 외과적 절제술로 전체 소장의 60% 이상이 소실됨으로써 발생하는 흡수 장애로 영양실조를 일으키는 희귀질환이다. 성장 및 생명 유지를 위해 총정맥영양법(영양소를 위장관을 거치지 않고 대정맥이나 말초혈관을 통해 공급하는 방법)과 같은 인위적인 영양 보충이 필요하며, 심하면 치명적인 것으로 알려졌다.
특히 신생아 10만명 중 약 24.5명에게서 발생하는 소아 단장증후군은 소아청소년기 성장에 심각한 영향을 끼치며, 하루 10시간 이상 소요되는 총정맥영양법으로 소아 환자와 가족들까지 정상적인 생활을 영위하기 어렵다. 아울러 주사 삽입 부위 감염에 따른 패혈증 및 혈전증 등의 심각한 부작용에 취약하고, 소아이기 때문에 생존율이 50% 이하로 아주 낮은 것으로 보고되고 있다.
2. RPD : 희귀 소아질환을 예방 또는 치료하는 신약 후보물질의 개발을 장려하기 위한 FDA의 특수 프로그램이다. RPD 지정을 받은 적응증으로 해당 후보물질의 시판 허가를 받으면 추후 다른 제품 개발 때 사용할 수 있는 '우선 심사권(Priority Review VoucherㆍPRV)'를 받을 수 있다. PRV는 FDA의 허가 심사를 6개월 내에 완료할 수 있도록 해주는 권리로, 다른 제품의 허가 절차 시 사용하거나 회사 간 PRV를 판매 또는 양도할 수 있다.

