바이오의약품 2개 포함 신약 5개가 올 2분기(4~6월) 국내 허가됐다.
식품의약품안전처가 14일 발표한 2분기 신약 및 희귀의약품, 신개발의료기기 등 신(新)의료제품 허가 현황에 따르면 신약은 화학의약품으로 전립선암 치료제인 '뉴베카정'(바이엘) 등 3개, 바이오의약품으로 혈색소뇨증 치료제인 '울토미리스주'(한독 수입) 등 2개가 각각 허가를 받았다. 신의료제품은 이 기간 동안 13개 품목이 허가됐다. <표 참조>
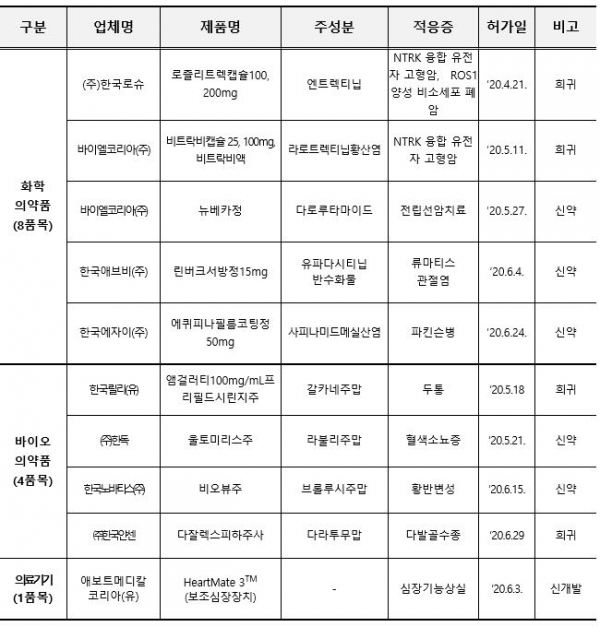
이 기간 허가된 신약엔 화학약품으로 류마티스관절염 치료제인 '린버크서방정15mg'(애브비)과 파킨슨병 치료제인 '에퀴피나필름코팅정50mg'(에자이), 바이오약품으로 황반변성 치료제인 '비오뷰주'(노바티스)가 포함됐다.
이 중 항암제가 6품목으로 가장 많이 허가됐다. 항암제는 뉴베카 외에 비소세포폐암 치료제인 '로즐리트렉캡슐100ㆍ200mg'(로슈), 고형암 관련 치료제인 '비트락비캡슐25ㆍ100mg'(바이엘), 다발골수종 치료제인 '다잘렉스피하주사'(얀센) 등이다.
의료기기에선 말기 좌심실 심장기능 상실 환자의 기계적 순환에 사용될 수 있는 보조심장장치인 'HeartMate 3TM'(애보트메디칼)이 신개발 의료기기로 허가됐다.
식약처는 코로나19 확산으로 국내외에서 어려움을 겪고 있는 상황에서 안전과 품질이 확보된 의약품 등 의료제품이 빠른 시일 내에 공급될 수 있도록 면밀하고 신속한 심사를 할 계획이다.
또 식약처는 신의료제품 허가 정보와 관련해 사회적 관심이 높은 품목 등 유용한 정보를 지속적으로 국민에게 투명하게 공개해 국민의 알권리를 강화해 나가기로 했다.

