일라이 릴리(Eli Lilly)는 ‘레테브모’(Retevmoㆍ사진)가 전이성 RET 융합 양성 비소세포폐암(NSCLC)과 갑상선암(MTC) 임상에서 지속적인 객관적 반응을 보인 임상 결과를 뉴잉글랜드저널오브메디신(NEJM)에 게재했다고 현지시간 27일 밝혔다.
레테브모는 전이된 성인 비소세포 폐암, 전신요법을 필요로 하고 종양이 전이된 12세 이상의 진행성 갑상선 수질암, 방사성 요오드 치료에 반응을 나타내지 않거나 방사성 요오드 치료가 적합하지 않고 전신요법을 필요로 하는 12세 이상의 진행성 RET 융합 양성 갑성선암에 대한 유일한 치료제로 올해 5월 미국 FDA의 허가를 취득했었다.
레테브모는 1/2상 임상(LIBRETO-001) 결과에 의해 승인을 받았고 확인 임상을 거쳐 유익성을 입증해야 한다.
릴리의 앤 화이트(Anne White) 종양학부문 사장은 “올해 초 FDA가 승인한 첫 RET 억제제가 최대 규모의 임상에서 얻은 상세한 안전성과 효능을 확인할 수 있어 기쁘다”면서 “이번에 관찰된 의미 있는 결과는 RET 기반 NSCLC와 갑상선암을 치료하는데 정밀 의학의 가치를 강화하고 암 환자들이 더 건강한 삶을 살 수 있도록 돕겠다는 릴리의 의지를 강조한다”고 밝혔다.
NEJM에 발표된 3가지 유형의 종양을 대상으로 한 임상은 피험자들은 증상이 진행되거나 독성이 수용할 수 없는 수준으로 나타날 때까지 레테브모 160mgdmf 1일 2회 복용했다. 주요 평가변수는 객관적 반응률(ORR)과 반응지속기간(DoR)이다.
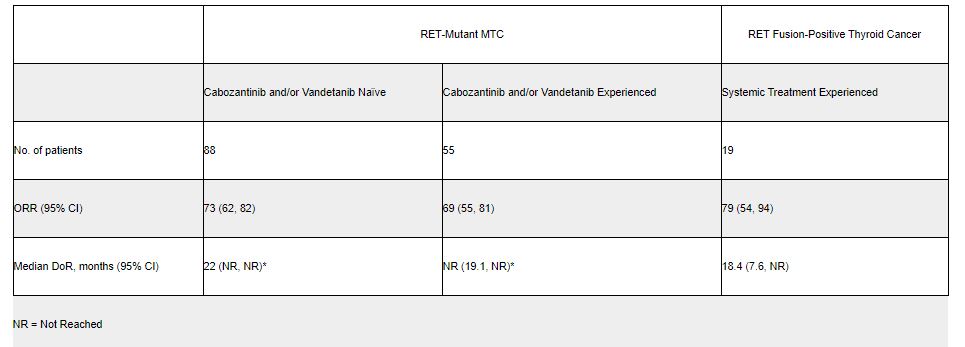
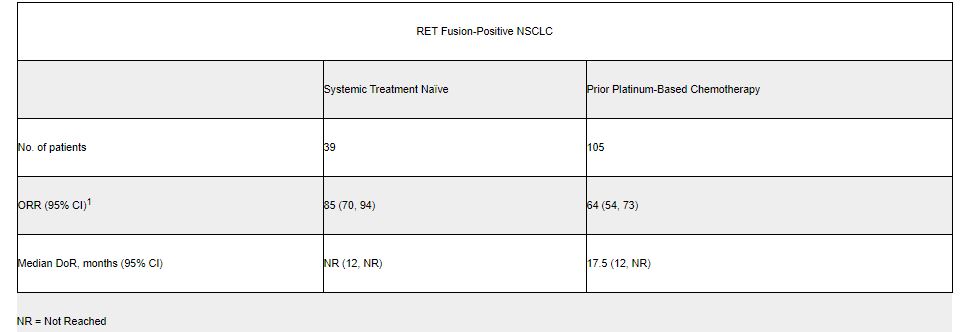
◇전이성 RET 융합 양성 비소세포폐암=백금기반 항암화학요법제로 치료를 받은 105명의 성인 환자들을 대상으로 한 임상에서 64%의 총 반응률을 보였다. 치료에 반응을 나타낸 환자들 가운데 81%가 최소 6개월 이상 지속적 반응을 나타냈다. 치료전력이 없는 RET 유전자 융합 양성 비소세포 폐암 환자 39명을 대상으로 이루어진 약효평가에서는 84%의 총 반응률이 도출됐다. 여기서도 치료 반응을 나타낸 환자 중 58%가 최소한 6개월 이상 지속적 반응을 나타났다.
◇갑상선 수질암=12세 이상의 소아 및 성인 환자들을 대상으로 평가가 이루어졌다. 임상은 ‘카보메틱스’(카보잔티닙), ‘카프렐사’(반데타닙) 또는 두가지 항암제로 치료를 진행한 전력이 있는 진행성 또는 전이성 RET 유전자 변이 갑상선 수질암 환자이거나 ‘카보메틱스’ 또는 ‘카프렐사’로 치료를 진행한 전력이 없는 진행성 또는 전이성 RET 유전자 변이 갑상선 수질암 환자 총 143명이 피험자들로 충원됐다. 임상 결과 치료전력이 있는 55명의 환자들에게서 69%의 반응률이 도출됐다. 반응을 나타낸 환자들 가운데 76%가 최소 6개월 이상 지속적 반응을 나타났다.
치료전력이 없는 88명의 갑상선 수질암 환자에서 73%가 반응률이 나타났으며, 반응을 보인 환자들 가운데 61%가 최소 6개월 이상 지속적인 반응을 보였다.
◇RET 유전자 융합 양성 갑상선암=12세 이상의 소아 및 성인 27명을 대상으로 임상을 한 결과 치료전력이 있는 19명의 환자들에게서 79%의 반응률이 도출됐으며, 이 가운데 87%가 최소 6개월 이상 지속적 반응을 나타났다. 방사성 요오드 이외에 다른 치료전력이 없는 8명의 환자들에게서 나타난 반응률은 100%로 집계됐다. 반응을 나타낸 환자들 가운데 75%에서 반응이 최소한 6개월 지속적으로 나타났다.