
로슈의 자회사인 PTC 테라퓨틱스(PTC therapeutics)는 척수성 근위축증(SMA) 치료제 ‘에브리스디’(Evrysdiㆍ사진)가 임상 3상(FIREFISH) 파트1의 2년 데이터에서 유아가 모터 마일스톤(motor milestone)을 개선했다고 발표했다.
에브리스디는 2개월 이상 된 척추근위축(SMA) 환자 치료제로 8월에 승인되었다. 임상 결과는 제 25차 세계 근육학회(WMS) 학술회의에서 발표됐다.
PTC 테라퓨틱스 최고 경영자인 스튜어트 W. 펠츠(Stuart W. Peltz) 박사는 “FIREFISH 장기 임상 결과는 SMA 환자가 계속해서 운동 기능을 개선하고 추가적인 발달 이정표를 얻고 있음을 보여줬다”면서 “우리는 에브리스디의 안전성과 내약성 프로필을 더욱 검증하고 치료의 지속적 유익성을 강화한다”고 말했다. 그는 이어 “에브리스디는 8월 승인 후 코로나19로 인해 가정에서도 복용할 수 있는 경구용 치료제의 필요성으로 강력한 상업적 출시 이유를 입증했다”고 덧붙였다.
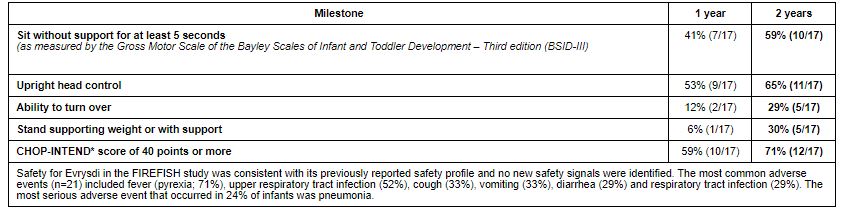
FIREFISH 임상 파트1의 2년 차 결과에 따르면 치료 용량의 에브리스디 투여군(영아 21명 중 17명)의 약 88%가 살아 있고 2년 동안 영구적 인공호흡이 필요하지 않은 것으로 나타났다.
임상에서 에브리스디의 안전성은 이전에 보고 된 안전성 프로파일과 일치했으며 새로운 안전 신호가 확인되지 않았다. 피험자 21명에 발생한 가장 흔한 이상 반응은 발열(71%), 상기도 감염(52%), 기침(33%), 구토(33%), 설사(29%), 호흡기 감염(29%)이 보고됐다. 영아 24%에서 발생한 가장 심각한 부작용은 폐렴이었다.
임상 분석 당시 가장 어린 영아는 28.4개월, 가장 나이가 많은 영아는 45.1개월이었다. 등록 나이는 평균 6.3개월이었다. 2세 때 까지 살아있는 14명의 영아 중 100%가 삼키는 능력을 유지했고 93%(13명/14명)은 입으로 음식을 먹을 수 있었다. 적정 용량으로 치료받은 17명의 영아 중 2명은 치료 8개월 및 13개월에 치명적 합병증을 경험했으며 1명의 영아가 연구에서 제외된 뒤 3.5개월 후에 사망했다. 그러나 어느 것도 에브리스디와 관련된 것은 없었다.<표 참조>
에브리스디는 SMA의 광범위하고 강력한 임상 프로그램 일환으로 450명 이상을 대상으로 연구되고 있다. 피험자는 증상 전 환자와 이전에 다른 SMA 치료제로 치료를 받은 60세 이하 환자를 대상으로 한다.
에브리스디는 생존운동신경세포(SMN) 단백질의 생존을 증가시키고 유지하여 SMA를 치료하도록 설계되었다. SMN 단백질은 몸 전체에서 발견되며 건강한 운동 뉴런과 운동을 유지하는 데 중요하다. 로슈는 SMA 재단 및 PTC 테라퓨틱스와 협력의 일환으로 에브리스디의 임상 개발을 이끌고 있다. 이 약은 로슈의 자회사 제넨텍(Genentech)이 미국 판매권을 가지고 있다.

