정부는 국내 코로나19 진단시약이 9개 제품 허가됐고, 수출용을 통해 170개국에 약 5억명분이 수출(공급)됐다고 4일 발표했다.
식품의약품안전처(처장 김강립)와 관세청(청장 노석환)은 코로나19 K-방역 체계에서 중추적인 역할을 하고 있는 진단시약의 허가와 수출 현황을 이같이 공개했다.
식약처는 현재(3일 기준)까지 국내 코로나19 진단 등을 위해 총 9개(유전자 7개ㆍ항원 1개ㆍ항체 1개) 제품을 정식 허가했다.
유전자 진단시약은 코로나19 감염자 확진을 위한 제품(6개)과 기침, 인후통 및 발열 등 증상이 비슷해 구분이 쉽지 않은 코로나19와 인플루엔자(독감)를 동시에 진단할 수 있는 제품(1개)이 있으며, 유전자 진단보다 정확도는 부족하지만 신속히 바이러스 여부를 확인할 수 있는 항원 진단시약 1개와 코로나 바이러스에 대한 항체 존재 여부를 확인할 수 있는 항체 진단시약 1개가 허가됐다고 식약처는 설명했다.
코로나19 진단시약 허가 제품 9개는 에스디바이오센서 제품 3개, 시선바이오머티리얼스 2개, 코젠바이오텍 2개, 바이오세움 1개, 캔서롭 1개로 나타났다. <표 참조>
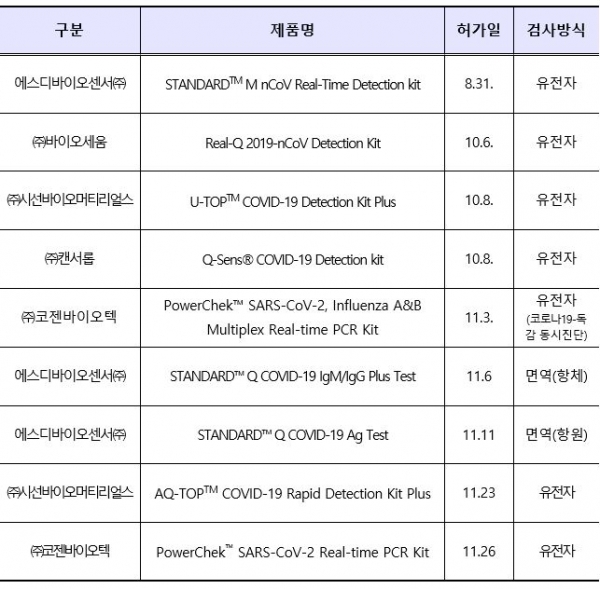
또 정식 허가를 신청(3일 기준)한 진단시약은 유전자 진단시약 18개, 항원 7개, 항체 15개로 40개 제품이 심사되고 있다.
질병관리청에 따르면 국내 방역에 사용 중인 코로나19 진단시약의 1일 최대 생산량은 약 59만명분이고, 현재까지 558만명분을 생산, 이 중 475만명분을 공급(3일 현재)됐고, 지금까지 총 313만건의 검사가 진행되고 있다.
수출용 코로나19 진단시약은 현재 221개 제품(유전자 105ㆍ항원 44ㆍ항체 72개)이 수출용 제품으로 허가돼 전 세계 170여개 국가로 4억9679만명분이 수출(11월30일 기준)된 것으로 집계됐다.
관세청은 올초부터 지난달까지 수출액이 약 2조5000억원(22억7000만달러) 성과로 수출이 급증하고 있다고 밝혔다.
4월부터 본격적으로 시작된 수출은 7월 이후 확진자 급증에 따라 가파른 상승세를 보였으며 10월과 11월에 연이어 수출 최고치(월별 기준)를 경신한 것이다. <그래프ㆍ표 참조>
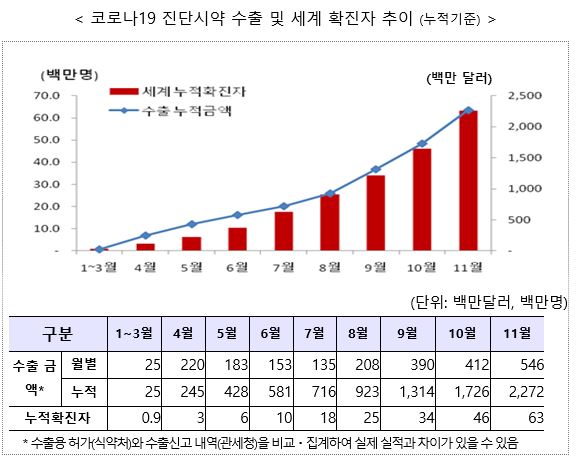
국가별론 인도(15.6%), 독일(13.2%), 네덜란드(9.6%), 이탈리아(7.8%), 미국(5.2%) 등으로 상위 5개 국가가 전체 수출액의 50% 이상을 차지했으며, 수출 국가도 1~3월 83개국에서 11월까지 170여개 국가로 지속적으로 확대되고 있다고 관세청은 덧붙였다.
앞서 식약처는 우리나라가 제안한 코로나19 등 감염병 진단기법이 국제표준화기구(ISO)의 국제표준(International Standard)으로 2일 제정됐다고 발표한 바 있다.

