천연물의약품의 연구개발(R&D)이 위축된 것으로 지적되고 있다.
보건의료기술정책위원회가 15일 공개한 천연물의약품(천연물신약)의 R&D 분석에 따르면 5년간(2015~2019년) 제품(천연물신약) 허가 건수는 전무하고, 글로벌 임상시험(미국 2건ㆍ유럽 1건)도 3건에 불과했다. 천연물신약은 2013년부터 올해(16일 8시 기준)까지 1건도 허가되지 않았다.
천연물신약은 8년 전 골관절염치료제인 레일라정(피엠지제약)과 아토피피부염치료제인 유토마외용액(영진약품) 이후 허가된 품목이 없다. 이마저도 유토마는 허가 취소됐다. 글로벌 임상시험도 바이오의약품(바이오신약)과 달리 천연물의약품은 이 5년간 동아에스티 임상 포함 고작 3건뿐인 것으로 집계됐다. 파이프라인 수도 2012년 55개에서 2018년 35개로 20개나 크게 줄었다.
◇파이프라인 수, 2012년 55개→2018년 35개… 환인ㆍ고려 등 제약사 임상도 줄줄이 실패
이런 R&D 위축은 2015년 보건복지부의 건강보험 약가 우대 제도 폐지, 2016년 식품의약품안전처의 독성자료 제출 일부 면제 제도 폐지 등 허가 절차 강화에 대한 영향도 있지만, 제약사들의 천연물 자원 및 정보 구축에 대한 투자에 비해 이를 실용화 성과로 연계할 수 있는 중개ㆍ비임상ㆍ임상 연구에 대한 연구 부족이 지적되고 있다.
실제 개발 과정에서 환인제약(치매치료제)과 고려제약(항골다공증제) 등 제약사들이 줄줄이 약효는 물론 안전성도 입증시키지 못하며 임상 문턱에서 좌절됐다. 유토마는 개발 및 허가 과정에서의 특혜 의혹이 올 국정감사를 통해 불거지기도 했다.
또 동ㆍ식물 등 생물과 생물의 세포 또는 조직배양 산물 등 생물을 기원으로 하는 물질로 개발돼 조성 성분 및 효능 등이 새로운 의약품으로 정의된 천연물신약은 4년 전부터 식약처에서 용어가 삭제된 바 있다.
◇제약계 "계획 수립보다 의약품 공정법ㆍ국가별 제도 차이 감안한 컨설팅 등 지원 필요"
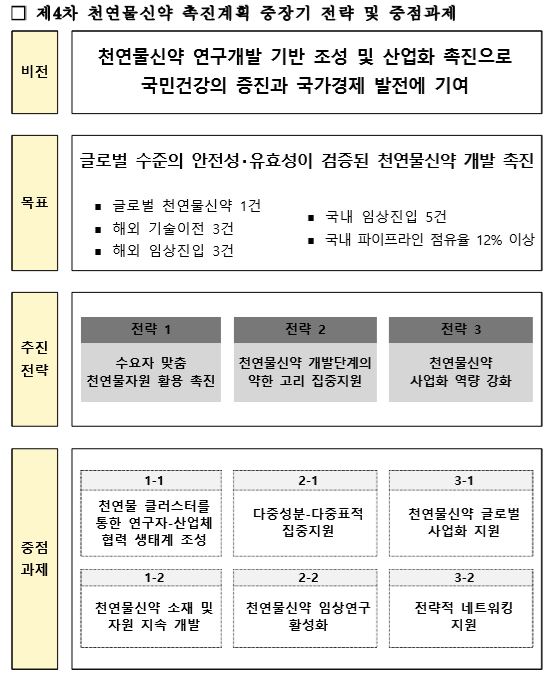
이런 와중에 복지부는 '3차(2015~2019) 천연물신약 연구개발 촉진 계획'이 완료됨에 따라 범정부 차원의 4차(2020~2024) 촉진 계획을 수립한다고 15일 발표했다.
복지부는 수요자 맞춤 천연물 자원 활용 촉진, 천연물신약 개발 단계의 약한 고리 집중 지원, 천연물신약 사업화 역량 강화를 3대 추진전략으로 정하고, 2024년까지 임상 진입 5건, 글로벌 임상 진입 3건, 외국 기술 이전 3건, 글로벌 천연물신약 1건 등의 성과 목표를 밝혔다. <그림 참조>
제약계 한 간부는 "복지부가 계획만 수립하기보다 글로벌 시장에서 인정받을 수 있는 의약품 공정 방법 및 국가별 인허가 제도 차이를 감안한 컨설팅 등 정부의 실질적 지원이 필요하다"고 강조했다.