식품의약품안전처(처장 김강립)는 결핵치료제 ‘리팜피신’ 함유 의약품에 대해 수거ㆍ검사한 결과, 니트로사민 계열 불순물(MNP2)이 검출(1.68~6.07ppm)됨에 따라 원료 중 MNP 함량을 낮추기 위한 불순물 저감화 조치를 시행한다고 21일 발표했다.
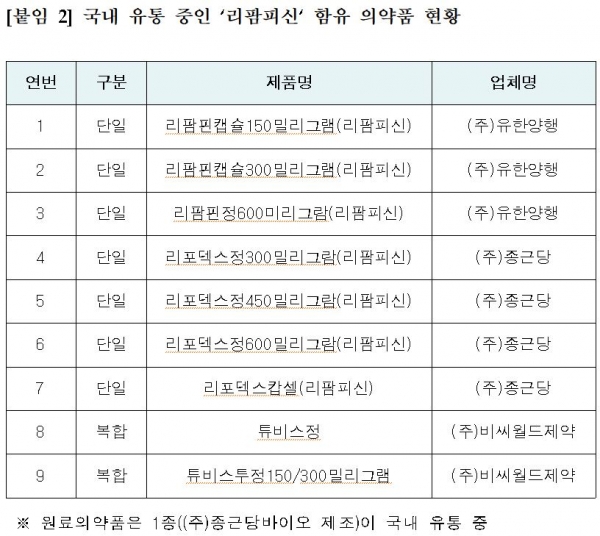
리팜피신은 결핵 1차 치료제로 사용되는 국가필수의약품으로 현재 생산ㆍ유통되는 제품은 완제의약품 9품목(3개사), 원료의약품 1품목(1개사)이 있다.
완제약 9품목은 비씨월드제약의 튜비스정 등 복합제 2품목, 유한양행의 리팜핀캡슐150mg 등 단일제 3품목, 종근당의 리포덱스캅셀 등 단일제 4품목이 허가됐다.
MNP(1-메틸-4-니트로소피페라진)는 니트로사민 계열(NDMA 등)의 화합물로 발암 가능성 평가 자료가 존재하지 않아 중앙약사심의위원회 자문을 통해 이미 알려진 NDMA 평가 자료를 적용, 잠정관리기준이 설정됐고, NDMA(N-니트로소디메틸아민)는 세계보건기구(WHO) 국제 암연구소(IARC)가 지정한 인체 발암 추정물질로 고혈압약 등에서 검출된 바 있는 비의도적 불순물을 각각 가리킨다.
식약처는 지난해 미국에서 리팜피신(미국명 : 리팜핀) 함유 의약품 중 일부에서 니트로사민 계열 불순물(MNP)이 잠정관리기준(0.16ppm)을 초과, 검출됨에 따라 국내 제품의 안전성을 확인하기 위해 지난해 9월부터 수거 및 검사를 진행했다.
잠정관리기준은 사람이 매일 의약품 1일 최대 복용량을 평생(70년) 복용할 때 자연발생적인 발암가능성에 더하여 10만분의 1의 확률로 암이 더 발생할 수 있는 니트로사민 계열 불순물의 1일 최대 섭취 허용량을 뜻한다.
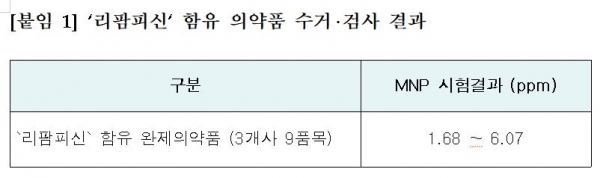
수거ㆍ검사 결과, 국내 유통 중인 모든 ‘리팜피신’ 함유 의약품에서 MNP가 잠정관리기준(0.16ppm)을 초과해 검출됐고 완제의약품에서의 MNP 함량은 1.68ppm~6.07ppm으로 나타났다고 식약처는 밝혔다.
이 검출 결과는 결핵 치료에 필수적인 의약품의 공급 부족을 방지하고 환자 접근성을 감안해 ‘유통 허용 한도를 설정한 미국의 기준(5ppm)과 유사한 수준이라고 식약처는 설명했다.
그러나 식약처는 잠정관리기준을 초과한 ‘리팜피신’ 함유 의약품이 대다수 환자에게 건강상 끼치는 큰 영향은 없을 것으로 판단했다.
이와 연관돼 리팜피신 복용 환자에 대한 인체영향평가는 해당 의약품의 일일 최대 복용량(600mg)을 일반적인 복용 기간(1년 이하) 동안 복용한 상황을 가정, 수행됐으며, 그 결과, 일반적인 상황에 더해 추가적으로 암이 발생할 가능성은 ‘10만명 중 0.29명’으로 아주 낮은 수준인 것으로 확인됐다.
이에 따라 식약처는 의료기관에 기존 처방 가이드라인 등에 따라 리팜피신 함유 의약품의 처방을 계속할 것을 권고했으며, 복용 환자에게는 건강에 우려가 있더라도 임의로 복용을 중단하지 말고 의약품을 처방한 의료진과 반드시 상의할 것을 당부했다.
식약처는 아울러 건강보험심사평가원의 처방 자료를 기반으로 실제 의약품 복용실태를 반영한 인체영향평가를 올해 실시해 복용환자의 건강에 끼치는 영향을 추가로 평가할 계획이다.