정부가 신약 등 新의료제품을 개발 단계부터 심사를 제도화한다.
기획재정부가 21일 공개한 新의료제품 촉진 방안에 따르면 보건복지ㆍ과기ㆍ산업부 및 식품의약품안전처 등이 범정부적으로 보건 위기 대응 의료제품에 대해 개발 단계부터 심사를 시작하고, 신속히 허가할 수 있는 체계를 상시 운영할 수 있도록 허가 관련 규제를 개선한다.
이와 연관돼 허가ㆍ심사 인력 확충 및 외부 전문가 활용 등 허가ㆍ심사 전문성을 높임으로써 신속하고 안전한 제품화가 지원된다.
먼저 정부는 치료제ㆍ백신, 진단기기 등 공중보건 위기 대응 의료제품에 대한 허가ㆍ심사 지원을 상시 적용할 수 있도록 제도화를 추진한다.
이를 위해 개발 단계부터 심사할 수 있도록 수시동반심사, 우선심사 등이 실시된다. 수시동반심사는 허가 때 제출 자료를 개발 단계별로 미리 제출하도록 하고 수시 심사하는 방식을 가리킨다.
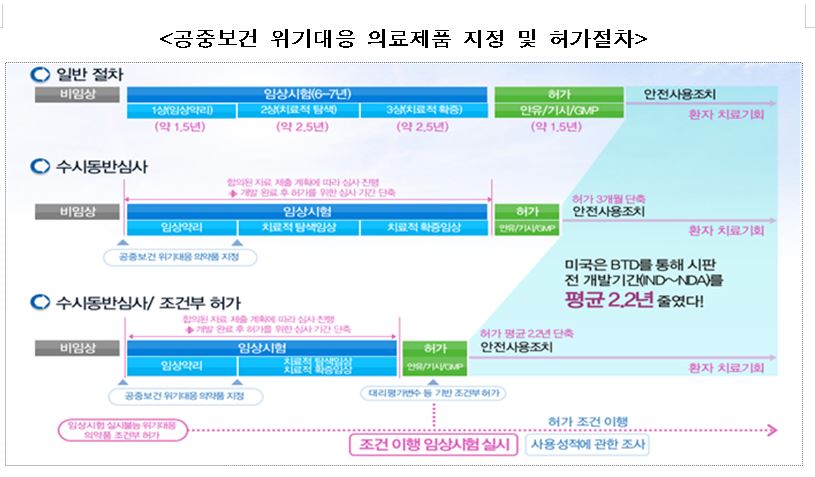
코로나19 치료제ㆍ백신의 경우 각각 40일 내 허가(180일→40일), 20일 내 국가출하승인(기존 90일→20일)이 정부 목표다. 국내에서 허가ㆍ심사 중인 치료제는 셀트리온 항체의약품(렉키로나주)과 아스트라제네카 백신(AZ코비드-19백신주)이다.
렉키로나주는 작년 12월부터, AZ코비드-19백신은 이달부터 허가를 위한 심사 중이며, 올해 국내 도입이 결정된 화이자ㆍ얀센 백신도 작년 12월부터 허가 신청 전 사전 검토 대상에 올랐다.
또 정부는 품목 특성을 반영한 '조건부 허가', '특례 제조(수입)' 등 新개념 허가ㆍ심사 요건도 도입해 제품화를 앞당길 수 있도록 했다.
조건부 허가는 품목 특성에 따라 안전성이 확인되고 임상적 효과 등이 있음이 예측되면 별도 기한 내 안전성 품목 특성을 반영한 ‘조건부 허가’, ‘특례 제조(수입)’ 등 新개념 허가ㆍ심사요건 도입한다는 계획이다.
조건부 허가는 품목 특성에 따라 안전성이 확인되고 임상적 효과 등이 있음이 예측되면 별도 기한 내 안전성ㆍ유효성 확증 임상 자료 제출을 조건으로 허가된다.
특례 제조(수입)는 공중보건 위기 상황에 대처하기 위해 관계 중앙행정기관의 요청 등에 따라 식약처장이 국내 미허가 의약품에 대해 제조ㆍ수입 승인되는 제도다.
이를 위해 정부는 의약품, 의약외품, 의료기기에 일괄 적용 가능한 '공중보건 위기 대응 의료제품 개발 촉진 및 긴급 공급을 위한 특례법' 제정을 추진하고, 국회 입법 과정에서 적극 지원할 예정이다.

