한미약품이 개발한 폐암 항암신약 ‘포지오티닙’(poziotinib)이 코호트5 임상(ZENITH20)에서 1일 2회 투여(BID, 1회당 8mg)가 1일 1회 투여(QD)에 비해 우수한 내약성, 투약 중단 감소 및 치료와 관련된 3등급 이상의 부작용 감소를 입증했다.
한미약품의 파트너사인 스펙트럼은 포지오티닙의 안전성과 유효성을 입증하는 코호트5의 예비 데이터를 현지시간 2일 발표했다.
이번에 발표한 결과는 8mg BID 투여가 항종양 활성을 개선을 시사한 것으로 주목을 끌고 있다. 이 결과는 2021년 3월 1일~2일까지 온라인으로 개최된 유럽종양학회 표적항암요법(ESMO TAT)에서 발표됐다.
스펙트럼 최고의료책임자(CMO) 프랑수아 레벨(Francois Lebel)은 ”약동학 모델에 의해 예측된 바와 같이 8mg BID 투여군은 초기 데이터에서 개선된 치료 효과와 낮은 부작용 비율을 보여주고 있다“면서 ”이 데이터는 올해 후반에 NDA 제출의 기초가 될 코호트2의 긍정적 결과를 기반으로 한다“고 밝혔다. 그는 이어 ”4월에 열리는 미국암연구학회(AACR)에서 추가 데이터를 보고 할 수 있기를 기대한다“고 덧붙였다.
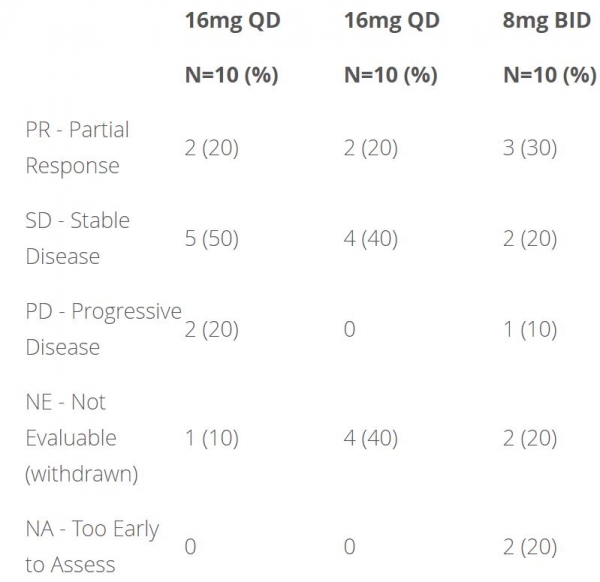
코호트5에 대한 ZENITH20 임상은 EGFR 또는 HER2 엑손20 삽입 변이가 있고 이전에 치료받은 비소세포폐암(NSCLC) 환자를 대상으로 BID투약으로 포지오티닙을 평가했다. 코호트5에서 포지오티닙 16mg QD 또는 8mg BID로 무작위 배정된 20명 환자 중 BID 투여군에서 개선된 반응에 대한 경향이 보고되었으며 환자의 30%가 부분 반응에 도달했다.
한편 스펙트럼은 지난해 12월 FDA가 과거 치료 경험이 있는 HER2 엑손20 삽입 변이 양성 비소세포폐암(NSCLC) 환자 대상 코호트2 임상 결과에 기반한 사전 미팅에서 신약시판허가(NDA) 제출에 동의해 내년 시판허가를 신청할 예정이라고 밝혔었다.