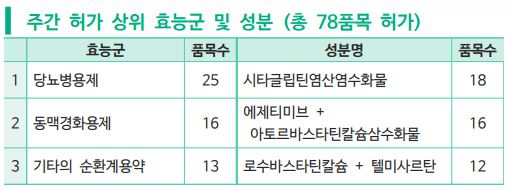
약학정보원(원장 최종수)은 2월 22~28일자 주간 허가 리뷰와 식별 등록 현황 정보 공개를 통해 신규 의약품 78개 품목이 허가됐다고 밝혔다.
효능군별 품목 수는 당뇨병용제 25품목, 동맥경화용제 16품목, 기타의 순환계용약 13품목이 승인을 받았다. 또 성분별로 따져보면 시타글립틴염산염수화물 성분이 18품목, 에제티미브+아토르바스타틴칼슘삼수화물 복합제가 16품목, 로수바스타틴칼슘+텔미사르탄 복합제가 12품목 등이 허가를 받은 것으로 나타났다.
한국다케다가 희귀질환인 유전성 혈관부종(HAE) 예방제 신약으로 라나델루맙(lanadelumab) 성분의 ’탁자이로주‘<사진>를 허가 받았다. HAE는 C1-에스테라제 억제제(C1 esterase inhibitor)의 결핍 또는 기능 이상으로 인해 단백질 가수분해효소인 칼리크레인(kallikrein)의 생성이 증가하는 희귀질환이다. 이에 따라 브래디키닌(bradykinin)이 과다 생성되어 사지, 복부 혹은 후두부 등에 부종이 발생하게 된다. 특히 혈관부종 환자에서 급성 발작이 발생하면 기도폐색, 장폐색 등을 유발하여 생명을 위협할 수 있는 치명적인 질환이다.
라나델루맙은 칼리크레인을 표적으로 하는 인간 단클론 항체로 혈중 칼리크레인과 결합하여 단백질 분해 활성을 억제함으로써 혈관 투과성을 증가시키는 브래디키닌(bradykinin)의 생성을 제한하여 HAE 환자의 발작을 예방한다. 성인 및 12세 이상의 청소년에서 유전성 혈관부종 발작의 일상적인 예방에 사용하도록 승인되었다. 단, 급성 유전성 혈관부종 발작치료에 사용해서는 안 된다.
한편 지난주에는 관장제 및 변비 치료제로 사용되는 소르비톨ㆍ도큐세이트나트륨(sorbitolㆍdocusate sodium) 복합제, 백혈병 치료제인 포나티닙 성분 제제 2개 품목에 대해 허가변경 지시가 있었다.
소르비톨ㆍ도큐세이트나트륨복합제의 품목 갱신 자료에 대한 안전성ㆍ유효성 검토 결과 기존 대비 ’위‘와 관련된 효능ㆍ효과가 삭제되고 '장관 수술 또는 검사를 위한 장내용물의 배설, 불응성 변비'에만 사용하도록 변경됐다. 또 포나티닙(ponatinib) 성분 제제의 미국 FDA 안전성 정보 검토 결과, 시판 후 조사 결과에서 각종 혈관 장애 이상 반응으로 동맥파열이 보고돼 주의사항에 신설됐다.