식품의약품안전처는 SK바이오사이언스 '스카이셀플루4가프리필드시린지'(세포배양 인플루엔자 표면항원 백신)를 재심사를 위하여 4년 동안 3세~18세 이하 소아ㆍ청소년 603명을 대상으로 실시한 시판 후 조사결과, 이상 사례의 발현율은 인과관계와 상관없이 18.57%(112/603명, 총 222건)로 보고되었다고 29일 발표했다.
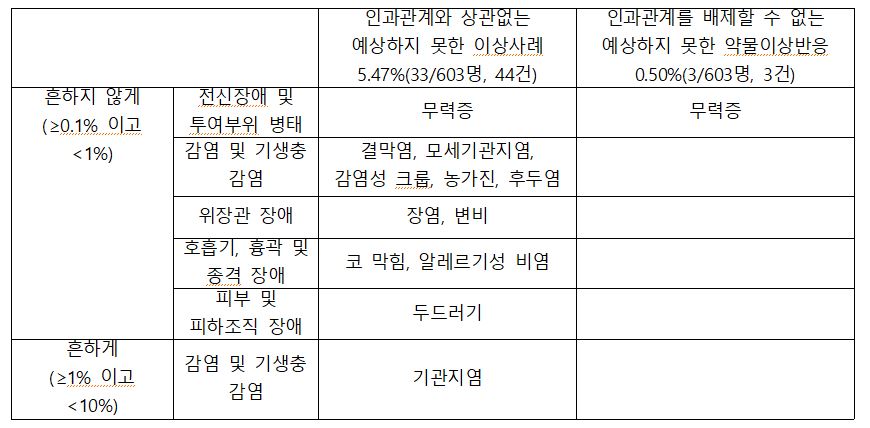
이 중 중대한 이상사례 및 중대한 약물이상반응 보고는 없었다. 또 인과관계와 상관없는 예상하지 못한 이상사례는 5.47%(33명/603명, 44건)이며 인과관계를 배제할 수 없는 예상하지 못한 약물이상 반응은 0.50%(3명/603명, 3건)이었다.
드물게 나타나는 이상 반응은 무력증, 결막염, 모세기관지염, 감염성 크룹, 농가진, 후두염 등이 보고 됐다. 또 위장관 장애로는 장염과 변비, 호흡기, 흉곽 및 종격 장애는 코 막힘, 알레르기성 비염이 보고됐다. 이밖에 흔하게 발생한 이상 반응은 기관지염이었다.
스카이셀플루4가프리필드시린지는 1회 접종으로 A형 인플루엔자 바이러스 2종과 B형 인플루엔자 바이러스 2종 등 총 4종의 바이러스를 예방할 수 있는 4가 백신이다. 이 제품은 만 19세 이상 성인을 대상으로 인플루엔자 예방제로 2015년 허가됐다.
오지혜 기자
admin@medisobizanews.com

