국내 제약사가 글로벌 빅파마를 상대로 기술수출이 가능한 글로벌 허가 단계에 진입한 파이프라인이 10개 정도인 것으로 나타났다.
대신증권 임윤진, 한송협 연구원은 최근 제약보고서에서 “35년 한국의 신약개발 역사 중 현재 글로벌 허가 단계에 있는 신약 후보물질은 10개로 최고 수준에 도달했다”고 말했다.
한국제약협회에 따르면 2002년 국내 제약바이오 기업의 매출액 대비 연구개발비 비중은 4.9%에 불과했으나 2019년 8.6%로 증가했고 그 중 매출액 상위 10대 기업 평균은 14.8%로 나타났다. 반면에 지난해 글로벌 신약 파이프라인은 약 1만7000여개로 연평균 5.8%씩 증가하고 있다.
이러한 약물들의 개발 성공 여부는 글로벌 빅파마들과의 파트너링에 따라 희비가 엇갈릴 확률이 높다.
글로벌 빅파마 중 하나인 화이자가 최근 발표한 자료에 따르면 화이자 임상 성공률은 21%로 업계 평균인 8% 대비 무려 13%나 높은 것으로 나타났다. 특히 임상 실패확률이 가장 높은 임상 2상의 성공률은 52%에 달해 업계 평균 대비 23%포인트가 높았다. 2015년 화이자의 임상 성공률은 업계 평균보다 낮은 5%에 불과했으나 경험과 노하우가 축적되며 성공확률을 점점 개선시킨 것이다.

글로벌 빅파마의 신약 파이프라인은 FDA의 허가 확률도 높은 것으로 나타났다. FDA의 후향적 연구에 따르면 미국 빅파마의 경우 최초 허가 심사에서 허가를 받을 확률(Firstcycle approval)이 해외 소재 제약사 대비 20% 이상 높은 것으로 확인되었고 중견 기업 간의 차이는 30%까지 벌어지는 것으로 나타났다. 이 같은 이유는 축적된 경험과 자본력을 바탕으로 임상 과정의 속도를 높이고 넓은 영업 유통망을 활용하여 허가 후 상업화 성공 가능성도 증대시킬 수 있기 때문이다. 빅파마들 역시 효율적인 연구개발을 위해 ‘오픈 이노베이션’ 전략을 통해 꾸준히 외부 물질 도입을 확대하고 있으며 이에 따른 라이센싱 파트너링 및 M&A 건수는 매년 증가하고 있다.
글로벌 컨설팅 기업 딜로이트(Deloitte)에 따르면 빅파마 후기 파이프라인 중 외부 기술도입 비중은 2015년 10%에서 2019년 27%로 증가했고 특히 항암제 관련 계약이 연평균 약 360건으로 가장 많은 것으로 나타났다.
국내 제약바이오에 대한 빅파마의 관심은 국내 신약개발 기술력과 역량에 비례하여 증가하고 있다. 해외 기술이전은 단순히 신약의 우수성과 잠재력을 인정받는 일회성 이벤트가 아니라 신약 파이프라인의 해외 임상 개발의 속도를 높이고 향후 허가 가능성을 높여줄 중요한 요소로 작용한다. 해외 파트너십을 활용하여 리스크를 줄이는 동시에 기초체력을 키워 R&D 투자를 확대함으로써 신약개발의 선순환 구조에 더 가까워질 수 있다.
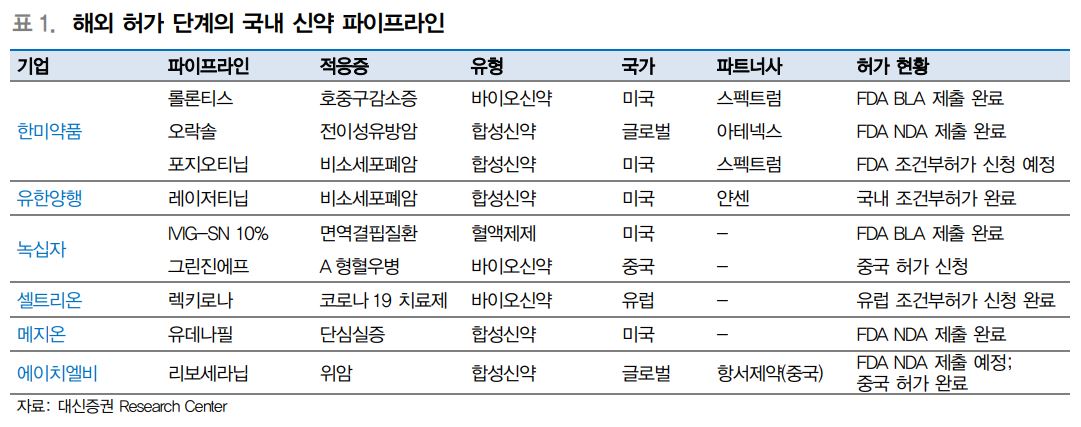
이에 대한 글로벌 임상단계에 진입, 빅파마에게 기술 수출이 유력한 후보물질은 유한양행, 한미약품, 종근당, GC녹십자 등 다양하다.
◇유한양행=얀센에 기술이전한 ‘레이저티닙’이 차세대 EGFR TKI로 개발 중이다. 레이저티닙은 기존에 EGFR TKI 치료 이력이 있는 EGFR T790M 변이 양성 NSCLC 환자 대상으로 진행한 단독 요법 임상 1/2상에서 ORR 58%, mPFS 11개월로 확인되며 타그리소와 유사한 결과를 보였다. EGFR T790M 변이 양성 비소세포폐암(NSCLC) 2차 치료제로서 유의미한 임상 효능을 인정받아 지난 1월 국내에서 조건부허가를 획득했다.
2020년 9월 유럽종양학회(ESMO)에서 얀센이 발표한 결과에 따르면, 레이저티닙과 EGFR/cMET 이중항체 ‘아미반타맙’ 병용 임상에 참여한 기존 치료 이력이 없는 EGFR 변이 NSCLC 환자 20명 모두에서 부분 관해(PR)에 도달하며 ORR과 CBR(임상적이득률) 100%로 나타났다. 타그리소 투여 후 재발한 환자 45명 중 16명에서도 임상적 효과를 확인하였다. 환자 한 명은 완전관해(CR), 15명은 부분관해(PR)에 해당하면서 ORR 36%, DCR은 60%로 나타났다.
타그리소 투여 후 내성이 생기면 사용할 수 있는 표준치료제가 없는 상황에서 레이저티닙의 결과는 더욱 긍정적이다. 얀센은 레이저티닙과 아미반타맙과의 병용 요법으로 글로벌 임상 3상을 진행 중이다.
◇한미약품=호중구감소증 치료 바이오 신약 ‘롤론티스’에 대해 5월 FDA 평택 공장실사 예정이며 이르면 6월 말 FDA 신약 허가 가능할 것으로 예상된다. 6월 ASCO 학회에서 RAF저해제 임상 1상 신규 데이터 발표가 예정되어 있다. 포지오티닙은 하반기 HER2 Exon 20 변이 비소세포폐암에 대한 FDA 조건부허가 신청 및 2022년 하반기 미국 출시 기대하고 있다. 또 하반기에는 자체 개발 중인 LAPS-Tri agonist NASH 2b상 탑라인 결과발표에 따라 기술수출 이 예상된다.
◇종근당=핵심 파이프라인은 자가면역질환 치료제 CKD-506(HDAC6 저해제, 자가면역질환)과 이중항체 항암신약 CKD-702(EGFR/c-Met 이중항체, NSCLC)이다. CKD-506은 HDAC6 저해를 통해 염증 악화를 촉진하는 단백질 및 염증세포 활성화를 억제하는 기전의 합성 신약으로 기존 부작용이 심한 경구치료제(JAK 저해제 등) 및 고가의 바이오 의약품을 대체 가능할 것으로 기대된다. 현재 유럽에서 임상 2상을 진행하고 있다.
CKD-702은 EGFR+C-Met에 결합하여 신호전달을 억제하는 기전의 이중항체 항암제로 기존 EGFR TKI에 의한 돌연변이 및 내성 문제를 해결할 것으로 기대되는 항암 신약 파이프라인이다. 현재 국내 임상 1상 진행 중으로 올해 4분기 내 용량 증량 Part 1 종료되며 내년 효능 확인을 위한 Part 2 개시가 예상된다.


