약물 개발단계에서 미국 FDA 승인까지 걸리는 평균 시간은 8.7년으로 알려졌지만 최근 패스트트랙과 우선 심사 등 제도를 이용하여 ’초 스피드‘로 승인을 받는 약물이 많아지고 있다.
생물학연구정보센터(BRIC)는 최근 ‘FDA 약물 승인 최신 동향 및 혁신 신약 트렌드 분석“(저자 곽승화) 리포트를 발표했다.
리포트에 따르면 폐암치료제 ‘타그리소’는 개발에서 승인까지 매우 단축된 2.2년이 걸렸고 그 뒤에 나온 면역 억제제 ‘캘코트’(Calcort)도 2.3년 만에 FDA의 최종 승인을 받았다.
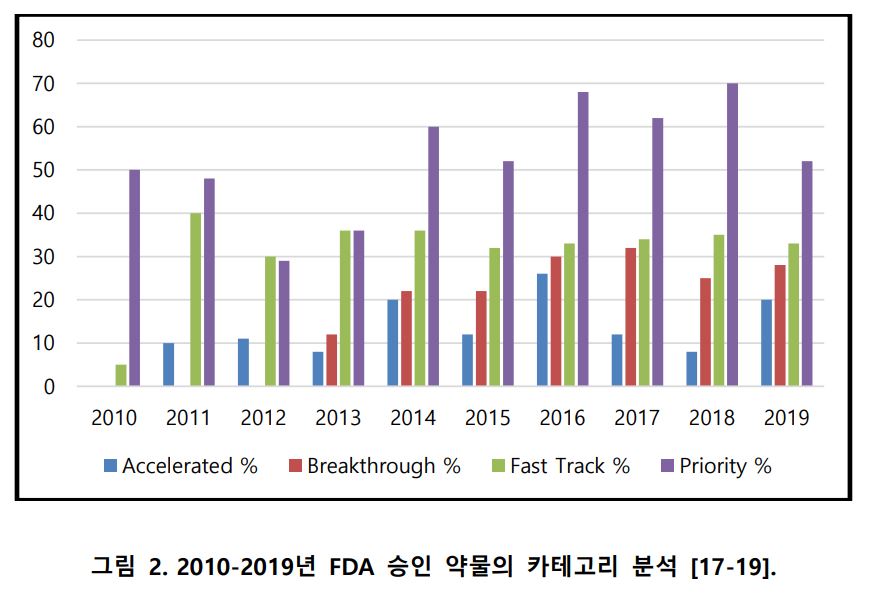
미국 FDA는 빠른 약물 개발을 위해 ▲패스트트랙(Fast Track) 지정 ▲혁신 신약(Breakthrough Therapy) 지정 ▲우선 심사(Priority Review) ▲가속 승인(Accelerated Approval) 제도를 운영하고 있다.
◇혁신 신약=이 제도는 예비 임상 데이터가 최근 치료결과보다 적어도 한 가지 이상의 뛰어난 결과가 있을 때 적용된다. 즉 기존 치료방법보다 치료결과가 좋다는 것을 증명해야 된다. 예를 들어 항암제의 경우, 독성 문제 때문에 약 처방을 줄여야 하는 치료법을 사용하게 되는 경우가 있다. 이를 극복하기 위해 독성이 적은 치료법이나 약물을 개발하게 된다면 혁신 신약 지정을 받을 수 있다.
FDA의 신약 승인은 2017년 46건, 2018년 59건에 이어 2019년에는 48건이었다. 특히 2019년 승인된 신약 48건 중 절반이 혁신 신약 심사제도로 승인을 받았다.
최근에 승인을 받은 암젠의 ‘루마크라스’(Lumakras)는 KRAS 억제제로 혁신 신약 심사를 받고 있다. 혁신 치료제는 임상 초기 높은 반응률이 나타나는 표적 치료제 개발을 활성화하기 위해 신설된 신속 승인제도다. 루마크라스는 KRAS G12C 변이 국소 진행 또는 전이성 비소세포폐암(NSCLC) 치료제로 NSCLS 환자의 약 14%가 이 KRAS G12C 변이를 갖고 있다고 알려져 있으며 미국에서는 매년 약 1만4000명의 새로운 환자가 보고되고 있다.
또 HER2 표적항체 약물 접합체인 ‘엔허투’(Enhertu)도 HER2양성 재발성 전이성 유방암 혁신 치료제에 속한다. 엔허투는 HER2 양성 절제불가 또는 전이성 위 또는 위식도 접합부 선암 환자의 치료를 위한 약물로도 2021년 승인을 받았다. 특히 HER2 양성 위암은 전체 위암 환자 5명 중 1명 꼴로 발견되고 있다.
이밖에 로슈의 항TIGIT 항체 '티라고루맙'(tiragolumab 면역조절제, PD-L1 발현 폐암 치료제)도 임상 2상에서 나온 데이터를 근거로 올해 혁신 치료제로 지정되었다. 갑상선암 등 치료에 쓰이는 ‘렌비마’(Lenvima)와 노바티스의 ‘비마그루맙’(bimagrumab)도 근육 손실 치료제로 2013년 FDA로부터 승인을 받았다.
◇우선 심사=이 제도는 현재의 표준 치료제보다 뚜렷한 가능성을 보일 때 적용된다. 10개월 정도 소요되는 일반 심사에 비해 매우 짧은 6개월에 끝낸다.
2021년 FDA의 우선 심사로 지정된 약물은 다케다의 폐암 치료제 ‘모보서티닙(mobocertinib)이 있다. 그 외에도 인사이트의 PD-1 억제 항암제 ’레티판리맙‘(retifanlimab)이 항문암 치료제로 우선 심사를 받고 있다.
◇가속 승인=이 제도는 시장에서 합리적인 가격 이점이 있을 것이라는 예측이 가능한 경우에 승인을 받을 수 있다. 또 승인 후에도 추가적인 테스트를 진행할 수 있는데 즉, 해당 질병에 수요가 있고 약물의 임상 결과에 약간의 불확실성이 있지만 질환에 잠재적 이점을 가져올 것이라 확실한 예측이 되는 경우에 적용된다.
예를 들어 보통 항암제를 통해 기대하는 효능은 환자들의 생존율 증가와 이환율 감소이지만 환자들이 사망할 때까지 몇 년을 기다려야 정확한 결과를 얻을 수 있게 된다. 조기 승인은 이러한 심사 방법 대신, 암 조직의 크기가 줄어드는 실험 결과를 바탕으로 실제 환자에게 후보 약물을 적용하면 사망률이 감소할 것이라고 예견을 통해 심사 결과를 내리는 것이다. 또 다른 예를 들어보면 골다공증 치료제의 경우 골밀도로 심사를 할 수 있으며 심혈관질환 치료제는 혈중 LDL 농도를 이용하여 심사를 내릴 수 있다. 최근 FDA에서 2003년 이후 18년 만에 치매 치료제 신약으로 조건부 승인을 받은 ’에듀헬름‘(Aduhelm)도 가속 승인 카테고리에 속한다. FDA는 에듀헬름이 제공하는 치료 이점이 현재 질병이 갖는 위험 측면보다 크다고 판단하여 승인을 했다.
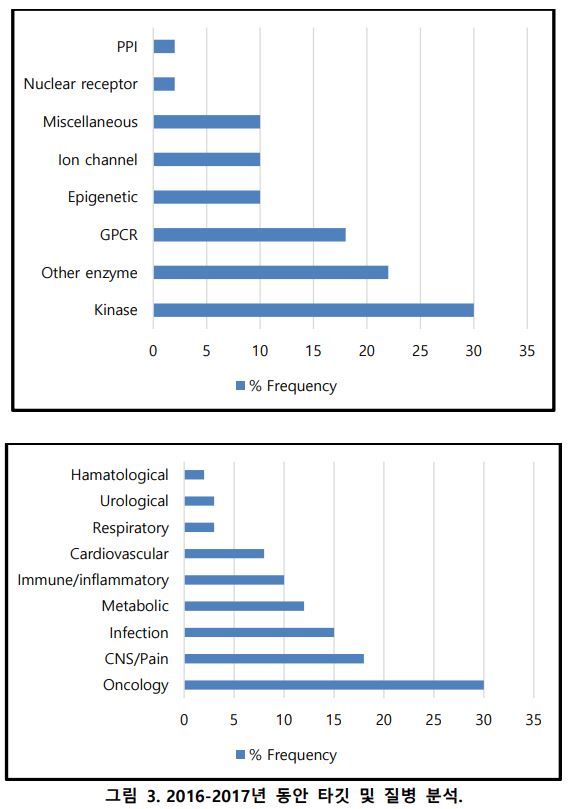
◇약물 승인 동향=2010년~2019년에 FDA에서 승인을 받은 Top 5개 적응증 중 가장 큰 비중은 항암제이며 감염병, CNS, 대사질환, 심장질환 순이다.
항암제 분야 관련 임상은 꾸준한 증가 추세를 보이고 있는데 치료를 위해 독성이 없으며 효과가 좋은 물질이 필요했던 것뿐만 아니라 암 발생 기전에 대한 지속적인 연구로 효율적인 약물 개발이 더 가능해졌기 때문이다.
특히 분자표적항암제나 면역항암제와 같은 신물질 연구가 집중되는 추세인데 2010년~2019년까지 승인된 항암제 타깃 약물 103가지를 비교 분석하였을 때 가장 큰 비중을 차지하는 적응증은 백혈병이며 유방암, 비소세포성 폐암이 뒤를 잇고 있다. 이러한 혁신적 연구를 지속해온 결과, 우리나라의 경우 암 환자의 생존률이 10년 동안 약 1.3 배 증가하는 결과를 보이기도 했다.