식품의약품안전처(처장 김강립)는 코로나19 백신과 치료제 등의 신속한 임상시험 진입을 지원하는 중앙임상시험심사위원회(중앙IRB, Institutional Review Board)의 정식 출범을 알리고 주요 참여 병원의 적극적인 협조를 구하기 위해 7월 30일 서울 송파구 소재 서울아산병원에서 출범식을 개최했다.
이번 출범식에서는 중앙IRB 협약병원 관계자와 심사위원들에게 ▲제도의 도입 취지 ▲추진 경과 ▲운영계획 등을 소개하고 제도의 원활한 정착을 위한 제언도 청취했다.
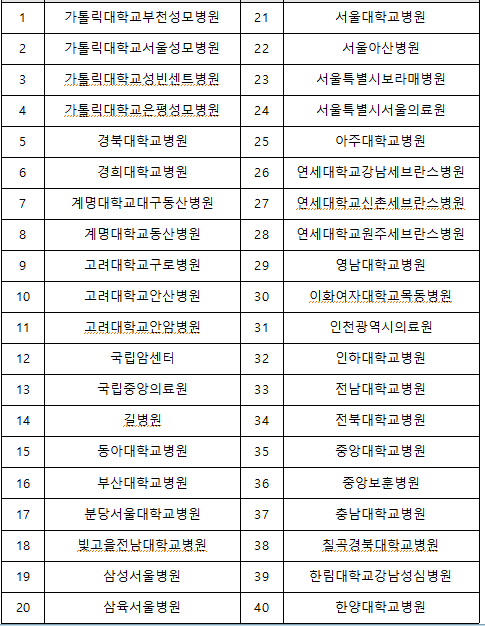
이번 중앙IRB 출범으로 여러 병원에서 실시하는 ‘다기관 임상시험’을 통합 심사할 수 있는 체계가 마련되면 병원마다 각각의 임상시험 계획을 심사했던 행정절차의 중복과 임상시험 승인까지 소요되는 기간이 단축되어 신속한 임상시험 진입이 가능해진다. 중앙IRB에는 코로나19 백신 등 임상시험 수행 기관, 임상시험수행 상위 기관 등 총 40개 병원이 참여할 예정이다.
또 참여기관의 심사 효율성과 신뢰성을 높이기 위해 개별 기관의 IRB 위원이 참여하는 공동심사위원회 형태로 운영할 계획이며 코로나19 치료제ㆍ백신, 항암제 등 공적 필요성이 큰 의약품의 임상시험을 시작으로 심사대상을 점차 확대할 예정이다.
김강립 식약처장은 이번 출범식에서 “중앙임상시험심사위원회의 출범이 규제과학을 바탕으로 한 국내 임상시험 심사 전문성을 강화하는 밑바탕이 되길 바란다”고 말했다. 아울러 “식약처는 코로나19 백신과 치료제 등의 신속한 개발을 위해 가능한 모든 지원을 아끼지 않을 것”이라며 “임상시험 수행 기관과 심사위원들도 중앙임상시험심사위원회에 대한 적극적인 관심과 참여를 바란다”고 당부했다.