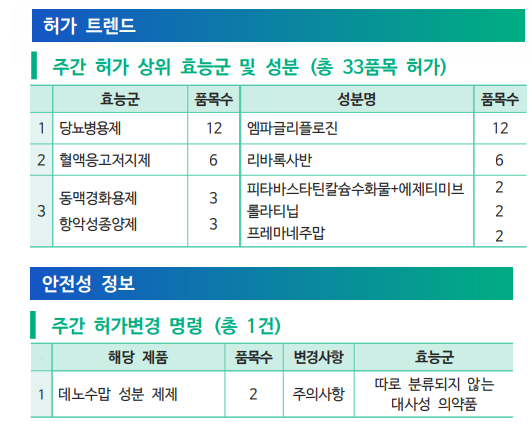
지난주(7월 26일~8월 1일) 당뇨병용제 12개 품목, 혈액응고저지제 6개 품목, 동맥경화용제 3개품목, 항악성종양제 3개 품목 등 총 33개 품목이 식품의약품안전처로부터 허가를 받았다.
약학정보원(원장 최종수)이 3일 제공한 '월간 허가 리뷰' 서비스에 따르면 지난주에 가장 눈에 띄는 승인 약물은 편두통을 유발하는 칼시토닌 유전자 관련 펩타이드(CGRP) 리간드에 결합하여 수용체와의 결합을 차단하는 단클론 항체 신약이다.
한독테바의 프레마네주맙(fremanezumab) 성분의 ‘아조비프리필드시린지주’ 및 ‘아조비오토인젝터주’는 성인에서의 편두통의 예방에 사용하도록 승인되었으며 1회 225mg을 1개월 간격 또는 1회 675mg(225mg 3회 연속)을 3개월 간격으로 피하 주사요법으로 허가를 받았다.
또 역형성 림프종 인산화효소(ALK)-양성 진행성 비소세포폐암 치료제 신약으로 롤라티닙(lorlatinib) 성분의 ‘로비큐아정’(한국화이자제약) 2개 용량(25, 100mg)이 허가되었다. 롤라티닙은 3세대 ALK 억제제로 ALK 및 ROS1 키나아제를 저해하여 암세포의 증식을 억제하는 기전을 가지고 있다. 알렉티닙(alectinib) 또는 세리티닙(ceritinib)을 1차 ALK 저해제로 치료받은 환자 또는 크리조티닙(crizotinib) 및 적어도 다른 1개의 ALK 저해제로 치료받은 환자 중 진행된 환자를 대상으로 단독요법제로 승인을 받았다.
식약처는 또 다발성 골수종 및 미만성 거대 B세포 림프종 치료제 신약으로 셀리넥서(selinexor) 성분의 ‘엑스포비오정20mg’(디케이에스에이치코리아)을 허가 했다. 셀리넥서는 exportin1(XPO1) 억제제로 단백질의 핵 밖 수출을 억제하여 핵 내 종양 억제 단백질을 축적함으로써 종양세포의 사멸을 유도한다.
이밖에 골다공증, 암 환자의 골격계 증상 예방 등에 사용되는 데노수맙 성분 제제의 재심사를 위한 국내 시판 후 조사 결과가 주의사항에 추가되었다.
골다공증 치료 등에 사용되는 데노수맙 60mg의 국내 시판 후 조사(6년간, 3221명 대상) 결과, 이상사례 발현율은 19.25%로 이 중 인과관계를 배제할 수 없는 중대한 약물 이상 반응으로 폐렴, 척추 압박 골절이 보고되었다. 더불어 인과관계를 배제할 수 없는 예상하지 못한 약물 이상 반응으로 통증, 대퇴골 골절, 설사, 치주염, 발열 등이 보고되었다. 암 환자의 골격계 증상 예방 등에 사용되는 데노수맙 120mg의 국내 시판 후 조사(6년간, 316명 대상) 결과, 이상 사례 발현율은 37.3%로 이 중 인과관계를 배제할 수 없는 중대한 약물 이상반응으로 발열이 보고되었다.