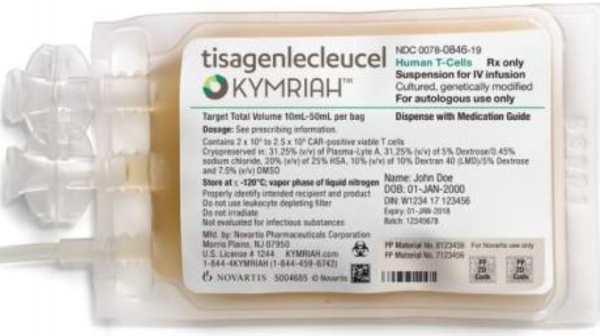
5억원 짜리 최초의 CAR-T 치료제 ‘킴리아’(타사젠렉류셀ㆍ사진)가 1일 건강보험심사평가원 암질환심의위원회(암질심)에 상정된다.
킴리아는 한국노바티스와 백혈병 환우회에서 강력한 급여 등재를 요구하고 있지만 초고가 약값 문제로 요양급여 적용 기준 등 심의과정에서 난항을 겪을 것으로 예상된다.
킴리아는 2017년 8월 30일 난치성 또는 재발ㆍ급성 림프구성 백혈병(ALL) 치료제로 미국 FDA 허가를 받았고 국내에서는 올해 3월 식품의약품안전처가 첨단재생바이오법에 따른 제1호 첨단바이오의약품인 CAR-T 치료제로 허가한 바 있다.
킴리아주는 환자로부터 채취한 면역세포(T세포) 표면에 암세포의 특정 항원을 인지할 수 있도록 유전정보를 도입한 후 환자의 몸에 주입하는 방식의 항암제다.
한국노바티스는 허가와 급여 절차를 동시에 밟는 허가-급여평가 연계제도를 활용했으며 급여기준에 대한 첫 논의가 이번 암질심에서 이루어진다. 한국백혈병환우회는 “킴리아 등재 신청이 3월 3일 이뤄졌지만 6개월이 지난도 암질심에 상정조차 되지 못했다”며 “신속한 건강보험 등재가 이뤄져야 한다”고 정부의 합리적 방안 마련을 촉구했다.
킴리아는 보험이 적용돼도 국내에 ‘올인원 치료 시스템’이 아직은 갖춰지지 않았다. 이 약은 환자 치료를 위해 전담 인력, 병상과 T세포 채취를 위한 GMP 시설 등 갖춰야 한다. 이로 인해 국내 대형병원들은 보건당국의 급여 적용 논의에 촉각을 곤두세우면서도 내부적으로 적지 않은 예산이 투입되는 CAR T-세포치료센터 운영 여부를 놓고 경제성 평가에 고심하고 있다.
현재 삼성서울병원이 킴리아 센터를 운영하고 있으며 서울대병원, 세브란스병원 등 대형병원들이 CAR T-세포치료센터 운영 계획을 세우고 있지만 구체적인 예산이나 계획은 알려지지 않고 있다.