일본에서도 제네릭 의약품 불법제조로 의약품 시장에서 불신이 커지면서 시장 개편과 함께 해외 시장 개척에 눈을 돌리고 있다.
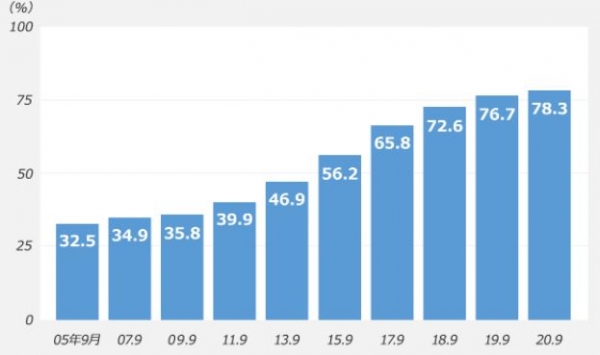
그동안 확대일로를 걷던 일본 제네릭 사업이 재편 움직임을 보이고 있는 것은 잇따른 의약품 품질 문제로 박리다매를 기본으로 하는 비즈니스 모델의 한계를 노출시켰기 때문이다. 여기에 일본에서 제네릭 의약품 사용 비율이 80%에 달해 양적인 확대로 인해 시장이 이미 포화상태로 성장에 한계를 보이고 있다.
제네릭 의약품 불신의 발단은 고바야시화공(小林化工)과 니치이코(日医工)에서 잇따라 발각된 불법제조다. 니치이코는 지난해 4월~올해 1월까지 품질 문제 등으로 75개 품목을 리콜했고 고바야시화공도 지난해 12월 경구용 항진균제에 수면제가 혼입된 약품을 복용한 245명이 피해를 호소하고 1명이 사망했다. 두 회사는 승인에서 벗어난 부정한 제조로 업무 정지 명령을 받았다.
이 후에도 초세도제약(長生堂製薬)과 쿄와약품(共和薬品) 등에서 불법 제조가 발각되어있어 생산 부족으로 시장에 공급 차질을 피할 수 없게됐다. 이달 11일에는 승인서와 다른 방식으로 의약품을 제조한 초세도제약은 업무 정지 명령이 내려졌다. 일본 제네릭협회(GE薬協)도 고바야시화공을 제명했고 니치이코와 초세도제약은 5년 간 회원 자격 정지 처분을 내렸다. 일본에는 약 200개 제네릭 기업이 있지만 일본 제네릭제약협회에 가입한 38개사에서만 공급하는 품목이 이달 12일 현재 1869개 품목에 이른다.
불법 제조 사태로 인해 제네릭 사업이 안고 있는 구조적인 문제가 부각되고 있다.
니치이코 불법 제조를 공표한 외부조사위원회는 “제네릭 의약품의 수요 증가에 따라 생산 수량과 품목 수가 급증했지만 이에 대한 인력과 시설이 없고 빡빡한 업무에 쫓겨 출하 시험 부적합 건수도 증가했다”고 지적했다.
일본은 2000년대 이후 정부에서 의료비를 줄이기 위해 제네릭 사용을 강력하게 추진해 왔다. 2002년에는 진료 보수 사용 촉진책이 시작되었고 2007년에 주요 정책으로 사용비율을 처음 30%로 설정하여 단계적으로 끌어 올리는 정책을 고수해 실제사용 비율이 80%까지 늘었다. 이렇게 되자 생산 및 품질 관리 체제가 따라가지 못하는 결과를 초래했다. 또 신규 진입이 잇따르면서 업체 간 경쟁도 격화되어 약값 하락의 악순환으로 빠져 들었다.
2005년 약사법 개정으로 공동 개발 및 위탁제조까지 풀려 과당 경쟁을 부추기면서 공동 개발사는 수탁 분 생산에도 쫓기게 되었다. 공동 개발 제품은 2019년도 기준, 전체 제네릭의 36.4%를 차지할 정도로 많아졌다. 제네릭 의약품의 소량ㆍ다품종 생산은 실익이 없고 더구나 약값이 내려가면 생산 규모를 확대시키지 않을 수 없다. 니치이코는 M&A로 사업을 확대했고 고바야시화공은 공동 개발로 사업을 키우면서 해결책을 찾았다.
니치이코의 불법제조를 조사한 토야마현(富山県) 의약품 제조ㆍ품질관리 전문부회는 7월에 정리한 보고서에서 “제네릭 약값의 극단적 인하로 공동 개발을 해야만 이익이 나는 구조”라고 지적하면서 ▲약가 제도 재검토 ▲생산 체제에 따른 품목 수 제한 ▲오리지널 의약품에 대한 제네릭 품목 수 제한 등을 검토하도록 정부에 요청했다.
후생노동성도 9월에 발표한 ‘의약품 산업 비전 2021’은 제네릭 의약품 정착을 위한 구체적인 방향으로 ▲제조 품목 수·생산량에 맞는 관리 체제 확보 ▲안정 공급 책임의 법적 뒷받침 ▲안정 공급·품질 확보 정보 공개 ▲공동 개발 방향에 대한 재검토 등을 내세웠다. 후생노동성이 5년~10년을 앞을보고 내건 이 시책으로 '혁신 신약'과 함께 '품질 확보ㆍ안정공급‘을 목표로 하고 있다.
일본 후생노동성 경제과장이었던 하야시 토시히로(林 俊宏)는 올해 3월 24일 열린 중앙사회보험의료협의회 총회에서 “제네릭이 80%를 차지하는 시대를 맞아 양에서 질로의 전환이 필요하다”면서 “업계 재편에 대해서도 진지하게 생각 할 시기가 왔다”고 발언해 업계 재편을 요구하는 목소리가 커지고 있다. 과다한 업체 수와 품목 수와 이에 따른 폐해는 이전부터 지적되고 있었지만 제네릭 의약품 품질 문제를 계기로 임계점에 다다른 모양새다.
하야시 과장은 “품질 확보와 안정적 공급 체제가 갖추어져 정보 공개를 할 수 있으며 해외 시장 확장과 새로운 영역에 도전하는 제약사가 제네릭 핵심을 담당할 것”으로 전망했다.
제네릭 비율이 80%에 달해 지금과 같은 양적 확대는 기대할 수 없고 품질 확보와 안정적 공급 비용이 증가하고 있어 제네릭 업체들은 일본 시장에서 새로운 비즈니스 모델 정착을 강요당하고 있다.
일부에서는 이미 움직임을 볼 수 있다. 니치이코, 사와이그룹홀딩스(HD), 토와약품(東和薬品) 등 3개 대기업은 2016년~2020년에 걸쳐 각각 외국 제네릭 업체를 인수해 해외 진출을 본격화하고 있다. 후지제약(富士製薬)도 2012년에 인수한 태국 기업을 중심으로 중국과 동남아시아 시장을 공략하고 있다.
신규 사업으로 사와이HD는 지난해 바이오 벤처인 뉴젠파마로부터 근위축측삭경화증(ALS) 치료제 라이센스를 취득하고 신약 개발에 참여했다. 토와약품은 2019년에서 만능유도줄기세포(iPS) 신약을 개발하는 타임테라퓨틱스(Time Therapeutics)와 신약 재창출을 하여 파킨슨병 등 치료에 사용되는 '브로모크립틴'(Bromocriptine)을 가족성 알츠하이머병 치료제로 허가를 받기 위해 의사 주도 임상시험을 지난해 교토에서 시작했다.
오하라약품(大原薬品)업도 소아암 등 희귀 질환 분야에서 신약 개발에 노력하고 있으며 이미 3개의 신약을 승인 받았다.
디지털 영역에 대한 투자도 활발해져 사와이HD는 지난해 이스라엘 기업에서 편두통ㆍ우울증을 대상으로 하는 디지털 의료기기를 개발ㆍ판매권을 취득했고 토와약품은 TIS와 합작 회사를 설립하여 지역 의료에 도움이 되는 IT 서비스 개발을 진행하고 있다.

