연구개발 중심 제약기업으로 거듭난 삼천당제약이 핵심 파이프라인인 'S-PASS' 기술을 접목한 당뇨병치료제ㆍ백신과 바이오시밀러 황반변성치료제 개발로 세계시장에 도전장을 냈다. 특히 당뇨병치료제와 백신은 주사제가 아닌 경구용 제제 개발이 목표다.
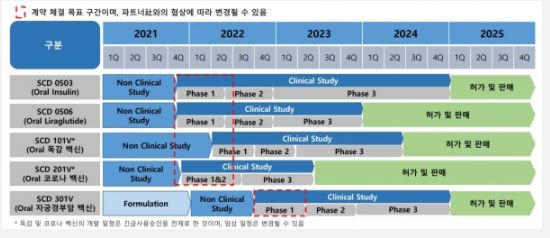
삼천당제약은 현재 이들 3개 적응증 7개 품목을 대상으로 비임상과 글로벌임상을 동시 진행하고 있다.<그림 참조>
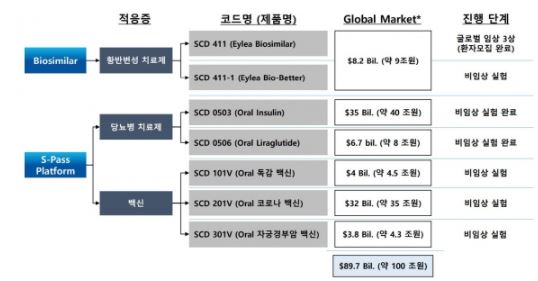
S-PASS 기술을 활용한 당뇨병치료제와 백신은 각각 2개 품목과 3개 품목이다. 당뇨병치료제는 SCD 0503ㆍSCD 0506으로 모두 경구용 제제다. 백신은 SCD 10V(독감)ㆍSCD 201V(코로나)ㆍSCD 301V(자궁경부암)으로 역시 먹는약으로 개발 중이다.
회사에 따르면 S-PASS 기술은 2013년부터 100억원이 넘는 연구개발비를 투자해 자체 개발한 것으로 주사제를 경구용 제형으로 전환하는 플랫폼기술이다. 2019년 특허협력조합(PCT) 국제특허를 출원할 정도로 기술력을 인정받고 있다. 기술의 핵심은 단백질 수용체를 이용해 경구약물의 상부 위장관 안에 있는 단백질 흡수 영역을 확장시켜 침투율을 높이는 것이다.
SCD 0503과 SCD 0506은 모두 비임상 실험을 완료한 상태다. 이 가운데 SCD 0503은 당부하검사에서 주사제와 비교해 동일한 패턴의 혈당 조절 효과가 확인됐다. 당화혈색소 검사와 혈당수치검사에서도 HbA1c 수치를 낮추고 공복 혈당 수준을 조절한다는 유의미한 결과를 얻었다. SCD 0506 역시 당부하, 당화혈색소 검사에서 효과가 나타났으며 체중 감소 효과가 주사제보다 10% 가량 우월하다는 점이 확인됐다.
삼천당제약은 SCD 0503과 SCD 0506의 허가 및 판매를 각각 2025년, 2024년으로 각각 잡고 있다.
백신 3개 품목은 모두 비임상 실험이 진행 중이다. 연구개발이 순조롭게 이뤄질 경우 코로나19 백신(SCD 201V)은 긴급사용승인 신청을 통해 2023년 3분기 허가와 판매를 시작할 예정이며 독감백신(SCD 101V)은 2024년 3분기 역시 긴급사용승인을 신청한다는 계획이다. 자궁경부암백신인 SCD 301V는 2025년 1분기 허가 및 판매가 목표다.
바이오시밀러로 개발 중인 황반변성치료제(SCD 411)은 글로벌 임상3상 단계에 있다. 지난 9월 임상환자 906명 모집을 최종 완료하고 임상이 진행 중이다. SCD411는 미국 리제네론이 개발한 '아일리아(Eylea)'가 오리지널이다.
삼천당제약은 SCD 411을 미국, 일본, 유럽 등의 해외 주요시장에 퍼스트 바이오시밀러로 출시하는 것을 목표로 삼고 있다. SCD 411 개발 로드맵도 여기에 맞춰져 있다. 미국(2020년 4월), 일본(2020년 3월), 유럽(2021년 10월)에 제형특허를 등록했으며 정제공정특허도 국내(2021년 3월)에 이어 해외 등록을 추진하고 있다.
허가와 판매 시점은 아일리아의 국가별 특허만료 시기를 겨냥하고 있다. 일본은 2023년 12월, 미국은 2024년 5월, 유럽은 2025년 5월 각각 특허가 끝난다. 삼천당제약은 이때를 퍼스트 바이오시밀러 출시 시점으로 보고 있다.
회사 관계자는 "삼천당제약의 중요 파이프라인인 당뇨병치료제, 백신, 황반변성치료제 3개 적응증의 글로벌시장 규모가 2020년 기준 100조원에 달한다"며 "부단한 연구개발 노력을 통해 세계시장에 삼천당제약의 우수한 제약기술을 알릴 계획"이라고 말했다.