일본 JCR 파마가 헌터증후군(무코다당증 2형) 치료제 ‘이즈카고’(Izcargo 개발명 ‘JR-141’)로 제2의 전성기를 맞고 있어 같은 치료제를 판매하고 있는 GC녹십자에 큰 자극이 되고 있다.
이즈카고는 JCR파마의 독자적인 뇌혈관장벽(BBB) 통과기술인 ‘J-Brain Cargo’를 적용했다. 헌터증후군은 라이소좀병의 일종으로 무코다당을 체내에서 분해하는 효소(Iduronate-2-sulfatase) 결손에 의해 발생하는 X염색체 열성 유전성 질환이다.
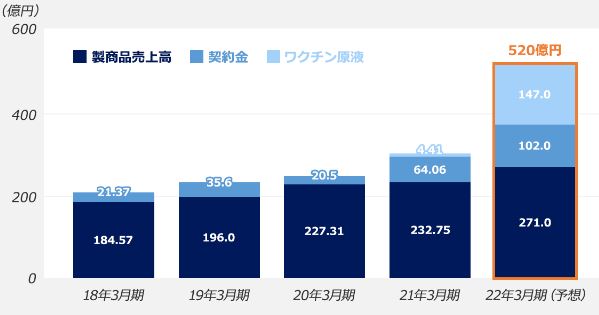
JCR 파마는 이 기술을 처음 탑재한 이즈카고를 올해 5월 일본에서 발매를 했고 9월에는 다케다와 제휴를 맺었다. 이즈카고는 발매 넉 달 만에 10억엔 매출을 올려 JCR파마는 2022년 상반기 매출액이 500억엔을 돌파할 것으로 전망하고 있어 글로벌 스페셜티 파마(Global Specialty Pharma) 꿈에 부풀어 있다.
JCR파마의 아시다 신(芦田信) 회장 겸 사장은 11월 2일 결산 설명회에서 “여러가지 질환 영역에서 획기적인 의약품 개발에 공헌할 수 있는 제2의 창업기를 맞았다”고 밝혀 올해가 JCR 파마에게 큰 전환점이 되었다.
올해 5월 일본에서 출시한 이즈카고(Pabinafusp Alfa)는 헌터증후군 치료제로 일본 후생노동성으로부터 우선 심사(선구 심사제) 대상 품목으로 지정됐다. 이와 함께 올해 9월 30일에는 다케다와 공동 개발ㆍ라이센스 계약을 체결했다. 샤이어 인수로 희귀질환 치료제를 강화한 다케다와의 파트너십으로 글로벌 마케팅에도 박차를 가하고 있다. 특히 J-Brain Cargo 기술은 JCR파마가 2005년부터 연구 개발을 진행해 온 기술로 15년 이상에 걸친 투자가 드디어 열매를 맺었다.
헌터증후군은 관절 구축이나 뼈 변형과 같은 특징적인 증상 외에도 지능 저하, 수면 장애, 경련 발작 등 중추 신경 증상이 나타날 수 있지만 기존 치료제로는 중추 신경 증상에 대해 효과를 기대할 수 없다. 헌터증후군은 남아에서 약 5만명에 1명꼴로 발병한다. 일본 환자 수는 약 250명이며 전 세계에서 약 7800명으로 추산된다.
헌터증후군은 2007년부터 효소 보충 요법으로서 샤이어社의 ‘엘라프라제’(Elaprase 이두설파제)가 사용되고 있지만 고분자 때문에 뇌혈관장벽을 통과할 수 없어 중추신경계에 대한 작용은 기대할 수 없었다. 이에 반해 이즈카고는 J-Brain Cargo 기술에 의해 BBB를 통과하여 뇌 내에 효소를 도달시킬 수 있으며 임상시험에서는 전신 증상뿐만 아니라 중추 신경 증상을 개선하는 효과도 확인됐다. 영유아기에 치료를 시작한 환자가 정상에 가까운 발달이 인정되고 8세 이상의 환자도 발달 연령 상승이 확인되었다.
이러한 중추 신경에 대한 작용이 평가되어 일본에서 약가 등재 때 40%의 유용성 가산이 붙었다.
한편 GC녹십자는 올해 일본 파트너사인 클리니젠(Clinigen K.K.)을 통해 일본 후생노동성(MHLW)으로부터 뇌실 내 투여 방식의 헌터증후군 치료제 '헌터라제ICV'의 품목허가를 획득했다. 헌터라제 ICV는 머리에 디바이스를 삽입해 약물을 뇌실에 직접 투여하는 치료법이다. 기존 정맥주사 제형의 약물이 뇌혈관장벽을 통과하지 못해 뇌실질 조직(cerebral parenchyma)에 도달하지 못하는 점을 개선한 것이다.
이즈카고는 일본 발매 이후 순조롭게 매출을 늘려 출시 4개월반 만에 50명 환자에게 사용되어 9월까지 9억8500만엔의 매출을 기록했다. JCR 파마는 “예상보다 빠르게 시장을 점유하고 있다”고 밝혔다. 이즈카고는 약가 등재 시 최대 예상 매출액 85억엔, 연간 최대 투여자를 110명으로 예상했다.
한편 GC녹십자의 헌터라제도 최근 해외 판매로 성장세를 보이고 있다. 헌터라제의 3분기 수출 실적은 174억원으로 작년 같은 기간 78억원보다 2배 이상 늘었다. 전 분기 58억원에서 1분기만에 3배 확대됐다. 헌터라제의 3분기 내수 매출이 57억원으로 전년대비 9.6% 증가했는데 해외 시장에서 큰 폭의 성장세를 실현했다. 헌터라제의 3분기 매출에서 수출이 차지하는 비중은 75.3%다. 회사 측은 “해외에서 판매가 크게 늘었고 러시아에서 수요가 급증했다”라고 설명했다.
헌러라제는 러시아, 이집트, 터키, 브라질 등 해외 14개국에서 판매 중이다.
아즈카고의 다케다와 제휴는 현재 승인 신청 중인 브라질을 포함하여 미국 이외 일본과 아시아 일부지역을 제외하고 전 세계를 대상으로 한다. 미국에서 사업화에 대해서는 별도 옵션 계약을 맺고 있으며 2022년에 예정하고 있는 글로벌 임상 3상이 완료된 단계에서 다케다가 권리를 행사할지 결정할 예정이다. 임상 3상은 JCR파마가 실시하며 표준치료제인 엘라프라제와 비교시험이 될 전망이며 임상 중간 결과에 따라 승인 신청도 검토하는 것으로 알려져 있다.
JCR파마와 다케다의 계약에 대한 상세한 재무적 내용은 비공개이지만 JCR파마의 아시다 회장겸 사장은 “경제적인 조건도 포함해 매우 만족하고 있다”고 강조했다. 다케다도 글로벌 판매를 위해 일본 기업과 라이센스를 맺는 것은 처음이다. 아시다 회장은 “J-Brain Cargo가 평가된 결과”라고 말했다.
타케다는 헌터증후군 치료제 분야에서 엘라플라제와 병용하여 골수 안에 투여하는 이두설파제 제형 ‘TAK-609’를 개발하고 있다. 2021년 4~9월기 결산설명회에서 JCR파마와 계약이 자사 제품에 미치는 영향을 묻는 질문에 다케다는 자세한 언급은 피했지만 전신 증상과 중추 신경 증상을 모두 치료할 수 있는 JCR 제품에 기대감을 보였다.
JCR파마는 현재 이즈카고 외에 뮤코다당증 I형에 대한 효소제제 ‘JR-171’과 뮤코다당증 IIIA형에 대한 ‘JR-441’ 등 기초연구단계를 포함해 16개의 라이소좀병 치료약을 개발 중이다. 이 중에서 JR-171에 이미 글로벌 제약사 여러 곳에서 관심을 보이고 있어 다음 회기 중에 계약을 목표로 하고 있는 것으로 알려졌다.
진행 중인 JR-171의 글로벌 1/2상 시험에서는 안전성을 확인하는 파트 1에 참가한 모든 피험자에서 뇌척수액 중의 헤파린 황산 농도의 저하가 입증되어 중추 신경 증상 효과가 기대되고 있다. 파트 2 임상이 끝난 후 임상 3상으로 진입할 계획이다.
JCR파마는 2020년 4월 미국 바이오제약사 아마젠(ArmaGen) 인수로 BBB 통과기술에 관한 지적 재산권을 취득해 J-Brain Cargo 기술을 글로벌 기술로 인정하는 계획도 있다. 이 회사는 라이소좀 병에 초점을 맞추어 개발을 진행해 왔지만 J-Brain Cargo 기술은 알츠하이머병이나 파킨슨병, 신경종양 등 다른 중추신경계 질환에도 발전할 가능성을 가지고 있다.