식품의약품안전처(처장 김강립) 식품의약품안전평가원은 11월 30일부터 2일간 개최되는 ‘제25차 아시아 의료기기 규제조화 회의(AHWP)’ 연례총회에서 국내 가이드라인이 국제 공통 가이드라인으로 채택되도록 추진한다.
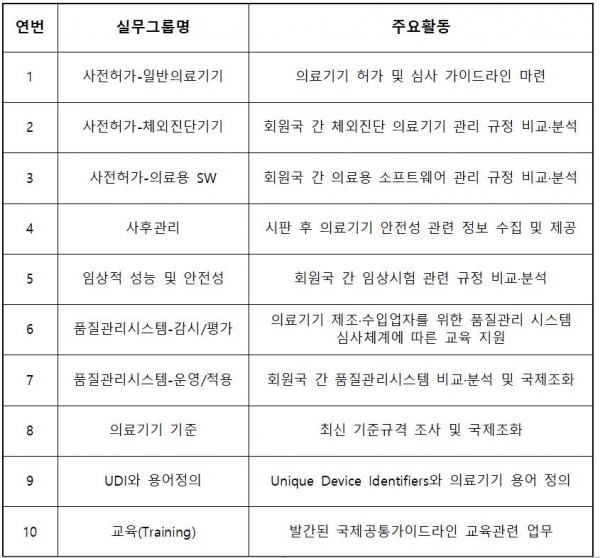
이번 연례총회에서는 우리나라가 제안한 ‘체외진단분석기 동일제품군의 변경 허가 가이드라인’을 국제 공통 가이드라인으로 채택하는 것에 대해 논의한다. 채택 시 국내 우수 제품의 해외 인증·수출이 용이해질 것으로 예상된다. 이 가이드라인은 체외진단시약에 동등한 성능을 가진 장비를 추가하는 변경 시 고려해야 하는 사항을 안내하며 주요 내용은 ▲동일제품군 변경 판단 기준 ▲장비 규격과 시약 성능 비교항목 ▲용어 정의다.
아울러 인공지능 관련 가이드라인 3종(인공지능 의료기기 용어정의, 규제적용 시 고려사항, 인공지능 의료기기 백서)도 국제 공통 가이드라인으로 채택되도록 실무협의를 진행할 예정이다. 참고로 현재까지 식약처에서 주도하거나 제안해 아시아 의료기기 규제조화 회의에서 채택된 국내 가이드라인은 총 5종이다.
이번 연례총회에서는 코로나19 대유행에 따른 AHWP 회원국과 WHO 국제기구의 대응 현황을 공유하고 의료기기 분야의 신기술 동향에 대해 서로 논의한다.
식약처는 이번 연례총회에서 ▲국내 의료기기 규제현황 ▲코로나19 진단시약 긴급사용승인(EUA) 현황 ▲인공지능 제품 심사사례 ▲IMDRF 의장국 활동 현황을 발표해 국내 규제과학의 우수성을 널리 홍보할 예정이다. 참고로 아시아 의료기기 규제조화 회의(AHWP)는 최근 미국 FDA, 아프리카, 남미 국가들이 가입 의사를 밝히고 있어 올해 연례총회에서 기구명을 GHWP(Aisa→Global)로 변경하는 안건을 승인할 계획이며 이에 따라 국제기구로서 위상과 영향력이 더욱 높아질 전망이다.