유바이오로직스는 자체 개발 코로나-19 백신 '유코백-19'(EuCorVac-19ㆍ사진)에 대한 임상 2상 중간결과를 확보했다고 29일 밝혔다.
유바이오로직스는 지난 7월부터 은평성모병원 등 국내 5개 기관에서 만 19~75세의 건강한 성인 229명을 대상으로 유코백-19의 2상을 진행하였다. 이에 따라 현재 임상 3상 비교임상 IND를 사전신청한 가운데 국산기술로 전공정 국내생산이 가능한 우리 백신의 개발 성공에 대한 기대감이 한층 커지게 되었다.
임상 2상의 안전성 측면에서 임상약과 관련된 중대한 약물이상반응은 발생하지 않았으며 2차 접종 이후 통증, 압통, 발열 등의 백신 이상반응이 1차 접종에 비해 낮아지는 경향으로 나타나 안전성과 내약성을 확인하였다.
면역원성 평가에서 결합항체가 및 중화항체가(FRNT50%)는 국제백신연구소, 세포성면역은 가톨릭대학교 의과대학 백신ㆍ바이오연구소에서 각각 실시하였다. 백신 2회 접종 완료 후 3주 경과 시점의 중화항체가는 저용량 대비 고용량에서 2.5배, WHO 표준혈청기준인 BAU 단위로 측정하는 결합항체가 역시 고용량에서 2.7배로 용량 비례성이 있음을 확인하였다. 이는 고용량군에서 백신 투여 전보다 중화항체가는 약 26.5배, 결합항체가(BAU)는 Anti-RBD 항체의 경우 1040배, Anti-S 항체의 경우 455배 이상이며 상업적으로 구입한 혈청패널(Access Biologicals LLC, USA)과 비교해 보면 회복기 환자혈청에 비해 약 9배 이상의 수치다.
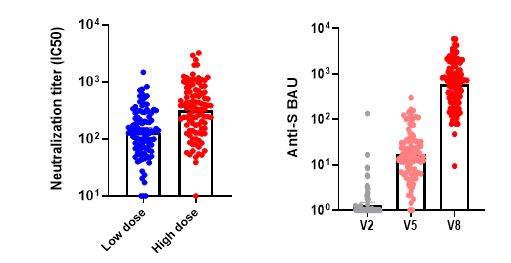
항체양전율(Seroconversion Rate)은 접종전 대비 중화항체가가 4배 이상 증가하는 기준에서는 95%이나 정량한계 하한을 고려할 때 99%였다. 세포성 면역도 용량의존적으로 유의한 결과를 확인하였으며, 각 용량에서 IFN-r와 IL-4를 측정한 결과에서 IL-4 대비 IFN-r의 발현이 높아 세포성 면역반응이 활발하게 일어났음을 알 수 있었고 더불어 ADE(Antibody-dependent Enhancement) 형태의 부작용 발생 가능성도 상대적으로 매우 낮을 것으로 기대된다.
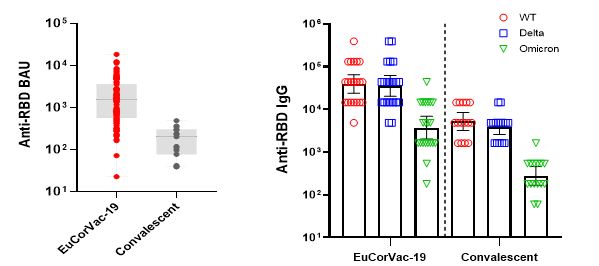
한편 회사 자체의 추가분석에 따르면 유코백-19 2상 접종자 혈청은 우한바이러스 대비 델타 변이주에 대해서 90%, 오미크론 변이주에서 9.5%의 교차반응을 보였으며 이는 회복기 환자 혈청패널 대비해서 각각 9배 및 13배 이상 높은 것으로 확인되었다.
유바이오로직스는 국내 1/2상 결과를 바탕으로 2022년 1분기 중 국내외에서 비교 3상을 실시할 예정이며 이어서 부스터 백신에 대한 임상 및 델타 또는 오미크론 등 변이주 대응백신에 대한 임상을 국내,외에서 단계적으로 진행하여 안전하고 효과있고 취급이 용이한 국산백신을 상품화하는 데 박차를 가할 예정이다.