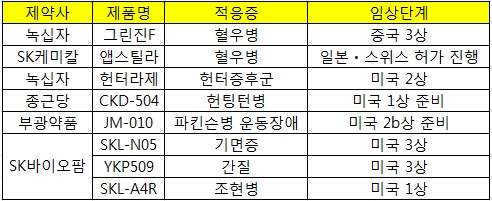
[메디소비자뉴스=이한울 기자] 국내제약사들이 희귀질환치료제 해외임상에 박차를 가하고 있다. <아래 표 참조>
‘그린진F’(혈우병치료제ㆍ녹십자), ‘HL2351’(크리오피린 관련 주기적 증후군 치료제ㆍ한독)이 임상에서 대상자 부족으로 중도 포기하는 어려움 속에서 해외로 눈을 돌리고 있는 것이다.
녹십자는 혈우병치료제 그린진F의 미국 임상 3상을 지난해 중단하고 같은해 7월부터 중국 3상을 진행하고 있다. 녹십자는 3년 내로 중국에 그린진F를 출시할 계획이다.
SK케미칼의 혈우병 치료 바이오신약 ‘앱스틸라’는 지난해부터 해외 허가가 이어지고 있다. 지난 2009년 글로벌 바이오의약품 개발사인 호주 CSL에 기술 이전된 앱스틸라는 지난해 5월 미국, 12월 캐나다에 이어 올해는 유럽과 호주에서도 시판허가를 받았다.
또한 일본과 스위스에서도 현재 허가절차를 진행하고 있어 연내 허가가 기대되는 상황이다.
녹십자의 헌터증후군치료제 ‘헌터라제’는 현재 미국에서 2상을 진행 중이다. 지난 2013년 미국에서 희귀약으로 지정받은 헌터라제는 1상을 면제받고 지난해 4월부터 미국 2상을 진행하고 있다.
녹십자는 헌터라제를 2012년 국내 출시했다. 이전까지는 샤이어의 엘라프라제가 전 세계 유일한 헌터증후군치료제였다. 녹십자는 임상을 통해 기존 엘라프라제보다 안전하면서도 치료효과를 높여 차별적 우위를 차지한다는 계획이다.
종근당은 지난해 전임상을 종료한 헌팅턴치료제 'CKD-504'에 대한 미국 임상 1상을 올해 진행할 예정이다. 헌팅턴 질환은 인구 10만명당 3~10명에게 발병하는 희귀질환으로 자율신경계에 문제가 생겨 근육 간 조정능력을 상실하고 인지능력 저하 및 정신적인 문제가 발생한다.
CKD-504는 신경섬유 내 물질 수송을 원활하게 함으로써 신경세포 기능과 생존을 증진시킨다. 시장에서 희귀질환치료제로 지정받을 경우 개발 속도가 빨라질 것으로 기대되고 있다.
부광약품의 파킨슨병 운동장애 치료제 ‘JM-010’은 유럽에서 1상을 마쳤고 연내 미국에서 2b상을 진행할 예정이다.
SK바이오팜은 개발 중인 파이프라인의 대다수가 희귀질환치료제다. 기면증치료제인 SKL-N05와 간질치료제 YKP509는 미국 3상을 진행 중이며 인지행동장애 동반 조현병 치료제 SKL-A4R은 미국 1상을 진행중이다.
업계 관계자는 “희귀의약품은 환자 수가 적고 마땅한 치료제가 없어 다른 의약품과 다르게 다국적제약사들과 경쟁할 우려가 없다”며 “또한 희귀약은 글로벌 진출이 비교적 쉽고 조기 허가 및 시장 독점의 이점이 있어 많은 제약사들이 글로벌 시장으로 눈을 돌리고 있다”고 밝혔다.