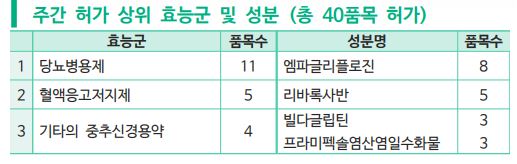
지난주(3월 8일~14일) 당뇨병용제 11품목 등 40개 의약품이 허가를 받았다.
약학정보원(원장 최종수)은 최근 3월 2주차 ‘주간 허가 리뷰’ 및 ‘주간 식별 등록 현황’을 공개했다.
이번에 공개된 주간 허가 리뷰의 허가 트렌드를 살펴보면 효능군별로는 당뇨병용제 11품목 외에 혈액응고저지제 5품목, 기타의 중추신경용약 4품목이 허가됐다. 허가 상위성분으로는 엠파글리플로진 성분이 8품목, 리바록사반 성분이 5품목, 빌다글립틴 및 프라미펙솔염산염일수화물 성분이 각각 3품목씩 허가됐다.
특히 지난주에는 베바시주맙(bevacizumab) 성분의 항암제인 ‘아바스틴주’의 국내 최초 바이오시밀러로 ‘온베브지주’(삼성바이오에피스)가 자료제출의약품으로 허가됐다. 온베브지주는 전이성 직결장암, 전이성 유방암, 비소세포폐암, 진행성 또는 전이성 신세포암, 교모세포종, 상피성 난소암, 난관암 또는 원발성 복막암, 자궁경부암에 사용하도록 허가되었다.
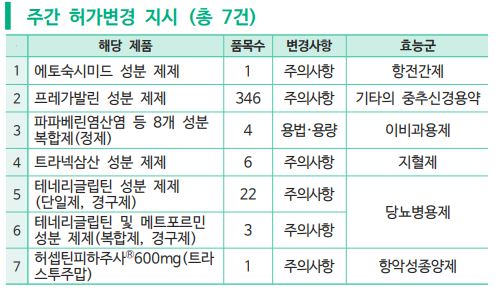
또 ▲항 전간제인 에토숙시미드 성분 제제(1품목) ▲중추신경용 약인 프레가발린 성분 제제(346품목) ▲이명증 치료제인 파파베린염산염 등 8개 성분 복합제(4품목) ▲지혈제인 트라넥삼산 성분 제제(6품목) ▲당뇨병 치료제인 테네리글립틴 성분 제제(단일제, 경구제)(22품목) ▲테네리글립틴 및 메트포르민 성분 제제(복합제, 경구제)(3품목) ▲유방암 치료제인 허셉틴피하주사 600mg(트라스투주맙) 등 7건의 허가변경 지시가 있었다.
신경병증성 통증 등에 사용되는 프레가발린 성분 제제의 유럽 집행위원회(EC) 안전성 정보 검토 결과, 이상 반응으로 호흡 억제가 보고되어 주의사항에 신설되었다. 이와 관련하여 호흡 기능 저하, 호흡기 또는 신경계 질환, 신장 장애 및 고령자는 중증 호흡 억제와 같은 이상 반응을 경험할 위험이 더 높을 수 있으므로 용량 조절이 필요할 수 있다는 내용이 포함되었다.
이와 함께 3건의 안전성 서한이 발표됐다. 식약처는 허가 또는 신고된 사항과 다르게 제조한 바이넥스사의 ‘닥스펜정’(이부프로펜) 등 6개 품목에 대해 잠정 제조·판매 중지를 명령하고 회수 조치했다. 이후 해당 제조소에 대한 현장 조사 결과 이미 조치한 품목과 동일한 방법으로 수탁 제조하고 있는 다른 업체의 32개 품목에 대해서도 3월 9일 자로 잠정 제조·판매 중지를 명령하고 회수 조치했다.
또 비보존제약의 제조소에 대한 현장 조사 결과, 제조(수탁 포함)한 ‘디스트린캡슐’(디아세레인) 등 4개 품목에 대해 허가 또는 신고된 사항과 다르게 제조하고 있는 것을 확인했다. 이에 따라 3월 12일 자로 해당 품목과 동일하게 수탁 제조하고 있는 다른 업체의 5개 품목을 포함해 총 9개 품목에 대해 잠정 제조·판매 중지를 명령하고 전 제조번호에 대해 회수 조치했다.