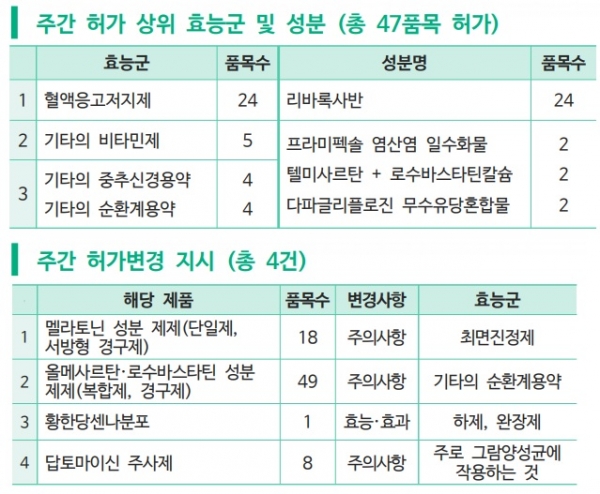
지난주(4월 19일~25일) 혈액응고저지제 24개 품목 등 총 47개 품목이 식품의약품안전처로부터 승인을 받았다.
약학정보원(원장 최종수)은 27일 주간 허가 리뷰를 통해 ‘자렐토’(리바록사반) 제네릭이 지난주에도 24개 폼목이 허가를 받았고 ‘기타의 비타민제’ 5품목, ‘기타의 중추신경용약 및 기타의 순환계용약’이 각각 4개 품목이 승인됐다고 발표했다.
또 허가 상위성분으로는 리바록사반 이외에도 프라미펙솔 염산염 일수화물, 텔미사르탄+로수바스타틴칼슘 복합제 및 다파글리플로진 무수유당혼합물 성분이 각각 2품목씩 허가됐다.
지난주 가장 눈에 띄는 허가 약품은 한국로슈의 시신경척수염 범주질환(NMOSD) 치료제 ‘엔스프링프리필드시린지주’(사트랄리주맙)였다. 자료제출의약품으로 허가된 엔스프링은 인간 단클론 항체(lgG2)로 인터루킨-6(IL-6) 수용체에 결합하여 IL-6 신호전달을 차단함으로써 염증 반응과 자가면역 반응을 억제하는 기전을 가지고 있다. 시신경척수염 범주질환은 난치성 자가면역질환으로 신경세포 표면에 존재하는 아쿠아포린-4( AQP4)의 기능을 파괴하는 자가항체로 인해 시신경과 척수에 염증이 발생하여 신경학적 손상과 시력 장애가 발생한다.
지난주에는 불면증 치료제 멜라토닌 성분 제제(단일제, 서방형 경구제) 18품목과 고혈압ㆍ고지혈증 치료 복합제 올메사르탄ㆍ로수바스타틴 성분 제제(복합제, 경구제) 49개 품목, 생약 제제인 황한당센나분포 1개 품목, 항생제인 답토마이신 주사제 8개 품목의 허가변경 지시가 있었다.
이 중 올메사르탄ㆍ로수바스타틴 성분 제제(복합제, 경구제)의 국내 시판 후 조사(6년간 602명 대상) 결과, 이상 사례 발현율은 2.66%로 이 중 인과관계와 상관없는 중대한 이상 사례로 다발성 장기 기능 부전 증후군, 바이러스 폐렴, 부신 선종이 보고됐다. 또 인과관계와 상관없는 예상하지 못한 이상 사례로 동성빈맥, 구인두 불편감 등이 보고되었다.
이와 함께 답토마이신 주사제는 미국 FDA 안전성 정보 검토 결과, 간질성 신세뇨관염(TIN) 및 호산구 증가와 전신성 증상을 동반한 약물 발진(DRESS)이 보고됐다. 따라서 이 약을 투여받는 동안 관련 증상이 발현하거나 악화 된 경우 의학적 평가를 반드시 받아야 하며 간질성 신세뇨관염 또는 DRESS 증후군으로 의심될 경우 약의 투여를 즉시 중지하고 적절한 처치를 해야 한다는 내용이 주의사항에 신설됐다.