지난주(5월 24일~30)에는 1형 신경섬유종증(NF1) 치료제 신약으로 한국아스트라제네카의 셀루메티닙(selumetinib) 성분의 ‘코셀루고캡슐’ 10mg, 25mg 2개 용량 등 21개 품목이 허가됐다.
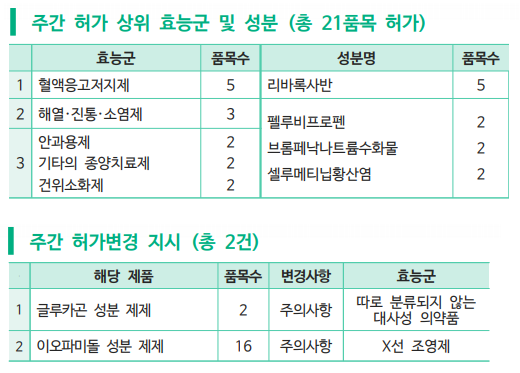
약학정보원(원장 최종수)은 1일 발표한 허가리뷰에서 혈액응고저지제(5개 품목), 해열ㆍ진통ㆍ소염제(3개 품목), 안과용제(2개 품목), 기타의 종양치료제(2개 품목), 건위소화제(2개 품목) 등 21개 품목이 판매 승인을 받았다고 밝혔다.
이 중 코셀루고캡슐의 적응증인 1형 신경섬유종증은 17번 염색체에 존재하는 NF1 유전자 돌연변이 또는 결손으로 인해 발생하는 신경계 유전질환이다. 1형 신경섬유종증 환자에서는 산발적으로 피부 색소 변화, 신경ㆍ골격계 장애가 나타나며 종양 발생 위험이 증가하게 된다. 주성분인 셀루메티닙은 종양세포의 성장에 관여하는 MEK 1/2(mitogen-activated proteinkinase 1/2)의 활성을 차단하여 과도한 세포 증식을 유발하는 RAS-RAF-MEK-ERK 신호 전달을 억제한다. 코셀루고캡슐은 증상이 있고 수술이 불가능한 총상 신경섬유종(plexiform neurofibroma)을 동반한 신경섬유종증 1형인 만 3세 이상 소아 환자 치료에 사용하도록 승인되었다.
식품의약품안전처는 지난주 ▲대사성 의약품 글루카곤 성분 제제 2개 품목과 ▲X선 조영제 이오파미돌 성분 제제 16개 품목에 대해 허가변경 지시를 내렸다.
저혈당증 치료 및 검사 전 소화관의 운동 억제에 사용되는 글루카콘 성분 제제는 미국 FDA 안전성 정보 검토 결과, 소아에게 투여 시 ‘위장관 운동을 일시적으로 억제하기 위한 진단보조제로써 안전성 및 유효성이 확립되지 않았다’라는 내용이 보고되어 주의사항에 신설되었다.
또 이오파미돌 성분 제제는 유럽 의약품청(EMA) 안전성 정보 검토 결과, 급성 전신 피진성 농포증(AGEP)을 포함한 중증 피부 유해반응(SCAR), 편마비, 코니스 증후군(Kounis syndrome)이 보고되어 주의사항에 신설되었다.
특히 이 약 투여 시 생명을 위협하거나 치명적일 수 있는 중증 피부 유해반응(스티븐스존슨증후군, 독성표피괴사용해, 급성 전신 피진성 농포증 포함)이 나타날 수 있으므로 환자들은 이 약 처방을 받을 시 중증의 피부 반응 징후와 증상에 대해 권고를 들어야 하며 환자에 대해 면밀히 모니터링해야 한다. 또 해당 반응을 나타내는 징후와 증상 발현 시 이 약의 사용을 중단해야 하며 중증 피부 유해반응이 발생한 경우에는 이 약의 치료를 개시해서는 안 된다는 내용이 포함되었다.