한국다케다제약(대표 문희석)은 지난 5월31일 식품의약품안전처로부터 자사 혈액응고인자 VIII 또는 IX의 억제인자 보유 혈우병A 및 혈우병B 환자 치료제 '훼이바주(anti-inhibitor coagulant complex, 혈액응고8인자항체우회활성복합체)'의 500U/10ml 포장단위를 추가 승인받았다고 17일 밝혔다.
회사에 따르면 훼이바주는 전 세계적으로 40년 이상 효능과 안전성 프로파일이 확인된 혈액응고 8인자 항체 우회약제로 혈액응고인자 VIII 또는 IX의 억제인자를 보유한 혈우병AㆍB 환자가 출혈 에피소드가 있을 경우 지혈ㆍ예방 목적, 수술 시 전후 관리, 출혈의 빈도를 줄이거나 이를 예방하기 위한 일상적인 예방 목적에 사용된다.
혈액응고인자 VIII 또는 IX의 억제인자를 보유하고 있는 혈우병AㆍB환자들의 출혈 에피소드 빈도 감소 및 예방을 위한 일상적 예방요법으로 미국 FDA 승인을 받은 치료제로는 훼이바주가 처음이라고 회사는 설명했다.
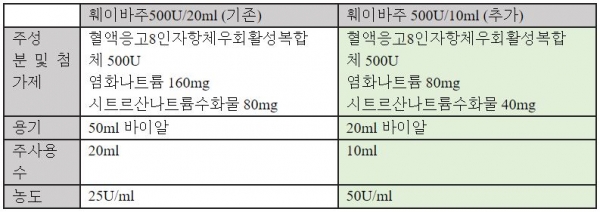
이 회사 혈우병사업부 김나경 총괄은 "훼이바주는 다양한 임상적 상황에서 처방이 가능한 제제로 장기간 확인된 효과와 안전성 프로파일을 바탕으로 혈우병 시장에서 필수적인 치료옵션으로 자리매김 중"이라며 "고농도 저용량인 훼이바주 500U/10ml로 치료 시 총 주사량이 감소해 평생 자가 주사치료가 필요한 혈우병 환자들의 치료 편의성이 개선될 것으로 기대된다"고 말했다.
이어 "한국다케다제약은 희귀혈액질환 분야의 글로벌 리더로서의 사명감과 책임감을 갖고 혈우병 치료와 환자들의 삶의 질 향상을 위한 도전과 노력을 멈추지 않을 것"이라고 덧붙였다.
한편 한국다케다제약은 혈우병 환자의 치료 편의성 개선을 위해 제8인자 유전자재조합 혈우병A 치료제 애디노베이트주(루리옥토코그알파페골, 혈액응고인자VIII, 유전자재조합)의 신규 용량 1500IU/2ml을 올 8월 국내 출시할 예정이다. 이에 따라 애디노베이트주는 250IU/2ml, 500IU/2ml, 1000IU/2ml, 1500IU/2ml, 2000IU/5ml 등 총 5가지 용량 옵션을 제공해 혈우병 환자들의 편의성을 향상시킬 것으로 기대되고 있다.
애디노베이트주는 장기지속형 제8인자 유전자재조합 혈우병A 치료제로, 기존 혈우병A 치료제인 애드베이트주와 동일한 제 8인자 전장 단백질에 기반해 개발됐으며 페길화 기술을 통해 애드베이트주 대비 반감기를 약 1.5배 연장하는 한편 약물 투여 횟수를 주 2회로 줄였다.

