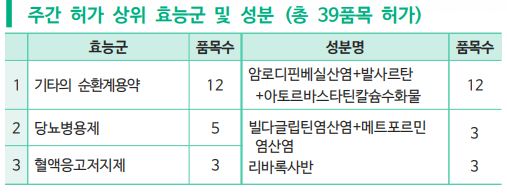
약학정보원(원장 최종수)이 제공하는 '주간 허가 리뷰'에 따르면 지난주(7월 12일~18일)에는 기타의 순환계용약, 당뇨병용제, 혈액응고저지제 등 총 39개 품목이 식품의약품안전처로부터 허가를 받았다.
이 중 시판 중인 당뇨병 치료 복합제 ’가브스메트정‘(빌다글립틴+메트포르민염산염)의 빌다글립틴에 염산염이 추가된 염 변경 제품이 승인되었다. 빌다글립틴염산염+메트포르민염산염 성분의 한미약품 ’빌다글메트정‘ 3개 용량(50/500, 50/850, 50/1000mg)이 자료제출의약품으로 허가되었다.
또 암로디핀베실산염+발사르탄+아토르바스타틴칼슘수화물 성분의 고혈압ㆍ고지혈증 치료 복합제도 허가를 받았다. 2020년 7월 암로디핀베실산염+발사르탄+아토르바스타틴칼슘수화물 성분 조합의 고혈압ㆍ고지혈증 치료 복합제가 최초 허가된 이후 지속적으로 해당 성분제품이 시판 허가되고 있다. 지난주에는 ’하이포지에이정‘(제뉴원사이언스), ’아나퍼지에이정‘(아주약품), ’엑스아토르정‘(한국휴텍스제약)이 각각 4개 함량씩 허가되면서 해당 조합에 대해 총 6개 업체(24개 제품)서 허가를 보유하게 되었다.
주간 안전성 서한은 1건으로 얀센社의 코로나19 백신이다. 유럽 의약품청(EMA)의 약물감시 위해평가 위원회(PRAC)에서 얀센 코로나19 백신 접종자에게서 나타난 모세혈관 누출 증후군 사례를 검토한 결과, 모세혈관 누출 증후군이 얀센 백신의 새로운 부작용으로 추가되어야 한다고 발표하였다. 더불어 모세혈관 누출 증후군 병력이 있는 사람들에게 얀센 코로나 백신을 접종하지 않도록 권고하였다. 이 발표에 따라 식품의약품안전처는 보건의료전문가 및 환자에게 관련 정보를 안내하는 안전성 서한을 7월 12일에 배포하였다.
주간 허가변경 지시는 1건으로 인플루엔자분할백신 성분 제제의 재심사를 위한 국내 시판 후 조사(4년간, 6개월 이상 만 19세 미만 소아 2033명 대상) 결과, 이상 사례 발현율은 30.74%로 이 중 중대한 이상 사례로 가와사키병, 기관지염이 보고되었다. 더불어 인과관계를 배제할 수 없는 예상하지 못한 약물 이상 반응으로 주사 부위 멍, 다리 통증, 저체온증, 농포성 발진, 중이염 등이, 인과관계와 상관없는 예상하지 못한 이상 사례로 연조직염, 독감 유사 증후, 변비, 여드름, 주사 부위 가려움 등이 보고되었다.