고가 신약인 발작성야간혈색소뇨증(PNH) 치료제 ‘솔리리스주’(에쿨리주맙)가 비정형용혈성요독증후군(aHUS) 신규 환자에 대한 사전 승인신청 2건이 받아들여지지 않았다. 또 같은 적응증 치료제인 ‘울토미리스주’(라불리주맙)는 신청 된 10건 중 6건은 승인되었고 4건은 거절되었다. 척수성 근위축증(SMA) 치료제 ‘스핀라자’는 신규 환자 급여신청 1건 승인과 2건의 자료보완이 결정됐다.
건강보험심사평가원 진료심사평가위원회는 솔리리스주, 울토미리스주, ‘스핀라자주’(뉴시너센), ‘스트렌식주’, 조혈모세포이식, 심실 보조장치 치료술(VAD) 등 6개 항목에 대한 심의 결과를 최근 공개했다.
솔리리스주와 울토미리스주는 모두 고가 신약으로 사전 승인 및 모니터링이 등재 필수요건이다. 또 사전승인 신청결과를 통보 받은 날부터 60일 이내에 이 약들을 투여해야 하며 만약 60일이 경과하여 투여할 때는 재신청 해서 승인을 받아야 한다. 이와 함께 솔리리스주와 울토미리스주 투약을 승인받은 요양기관은 6개월마다 모니터링 보고서를 제출하고 솔리리스주 aHUS의 경우 치료 시작 후 2개월에 초기 모니터링 보고서를 추가 제출해야 한다.
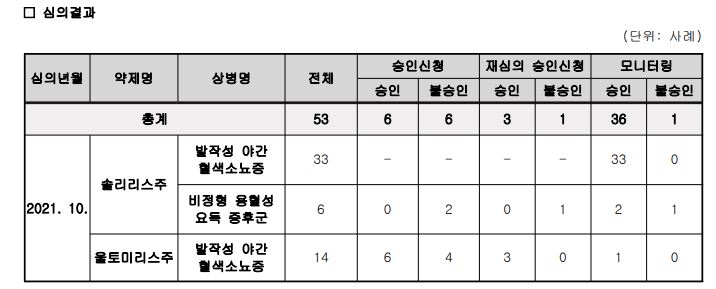
심의 결과 올해 10월에 솔리리스주와 울토미리스주는 사전승인신청 53건 중 승인과 불승인을 각각 6건씩 결정했다. 또 재심의 승인신청에 대해서는 3건은 승인 1건을 불승인 처리했고 모니터링에서는 36건 승인, 1건 불승인 결정을 내렸다. 약제별로 살펴보면 솔리리스주는 PNH에서 모니터링 신청 33건을 승인했고 aHUS 적응증은 신규 2건 불승인, 재심의 1건 불승인, 모니터링 2건 승인 및 1건 불승인으로 결정했다.
울토미리스주는 PNH에 대한 신규 환자 승인신청 10건 중 6건 승인과 4건 불승인, 재심의 3건 승인, 모니터링 1건 승인이 이뤄졌다.
한편 울토미리스주는 1병당 559만8942원에 등재되었으며 환자 1인 당 초기 용량 투여 2주 후부터는 8주마다 한번씩 유지용량을 투여 받아야 한다. 솔리리스는 1바이알(30ml) 당 513만2364원의 보험 상한금액으로 격주에 3바이알 씩 투여하면 1년 약값이 4억여원이 드는 고가약이다.
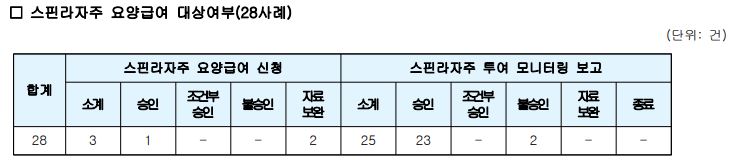
한편 스핀라자는 3건이 신청되어 1건은 승인 되었고 2건은 자료보완 요청됐다.
자료보완 요청 두 건 모두 유전자 결손이 확인된 사례다. 37세 남성이 신청한 건은 제출된 자료만으로는 만 3세 이하에 척수성근위축증 관련 임상 증상과 징후 발현 여부가 명확하게 확인이 되지 않으면서 자료보완 요청을 했고 30세 남성이 신청한 또다른 건은 환자 질병 경과가 오래 되면서 척추측만증이 있어 안정적으로 척추관주사를 받을 수 있을지 확인이 필요해 자료보완이 요구됐다.
스핀라자는 5ml 한병 당 보험상한가가 9235만원이다. 급여 승인 이후 4개월마다 유지용량 투여 전 모니터링 보고서를 제출해야 한다.