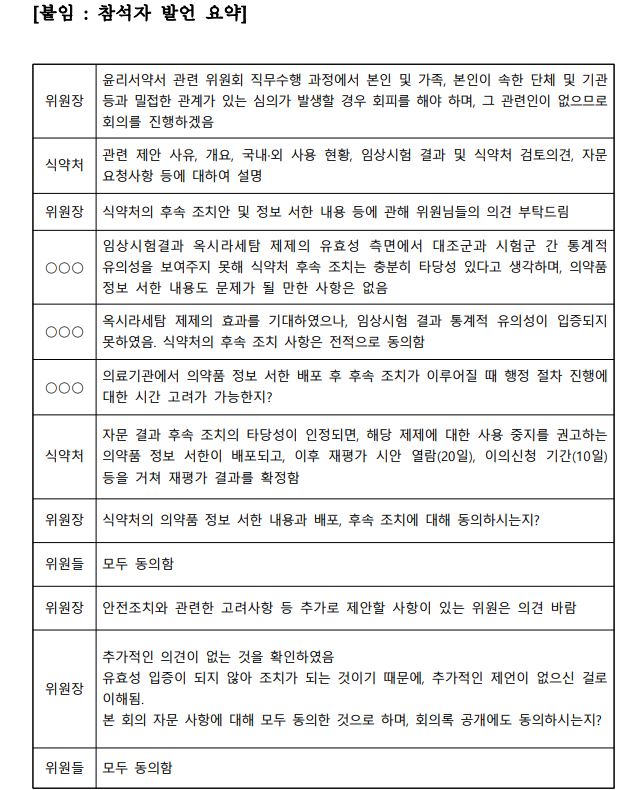
의약품 재평가 결과 유용성을 입증하지 못한 뇌기능 개선제 ‘옥시라세탐’ 성분 제품에 대한 식품의약품안전처의 회수 등 후속 조치에 대해 중앙약사심의위원회(중앙약심) 위원들 전원이 동의했다.
식약처가 최근 공개한 중앙약심 회의록에서 ‘안유 -안전성ㆍ유효성 평가’ 소분과위원회 12명 중 참석 위원 9명 모두가 임상시험 결과 효능ㆍ효과를 입증하지 못한 옥시레사탐 제제에 대한 의약품 정보 서한 및 규정에 따른 행정절차 계획의 타당성이 인정된다고 했다.
현재 옥시레세탐 제제는 2월 21일부터 회수절차를 진행 중이다. 다만 옥시라세탐 제제는 재평가에서 안전성에는 문제가 없어 제약사 자진 취하 형식으로 퇴출된다.
이날 회의에서 중앙약심 한 위원은 “임상시험 결과 옥시라세탐 제제 유효성 측면에서 대조군과 시험군 간 통계적 유의성을 보여주지 못해 식약처 후속 조치는 충분히 타당성 있다”고 밝혔다. 또 다른 위원도 “옥시라세탐 제제의 효과를 기대하였으나 임상시험 결과 통계적 유의성이 입증되지 못하였고 식약처의 후속 조치 사항은 전적으로 동의한다”고 말했다.
식약처는 중앙약심 위원의 행정절차 진행에 대해 “자문 결과 후속 조치 타당성이 인정되면 해당 제제에 대한 사용 중지를 권고하는 의약품 정보 서한이 배포되고 이후 재평가 시안 열람(20일), 이의신청 기간(10일) 등을 거쳐 재평가 결과를 확정한다”고 답변했다.
박찬영 기자
admin@medisobizanews.com

