식품의약품안전처가 국내 임상시험 활성화를 위해 '임상시험용 의약품 품질 심사 개선방안'을 내놨다.
이 방안은 임상시험용 의약품의 품질 심사의 효율성을 높이는 한편, 신속한 임상 진입을 위해 마련됐다. 업계에선 임상시험의 첫단추를 꿰기 위한 불필요한 요소들이 정리돼 임상시험 활성화에 도움이 될 것으로 기대하고 있다.
식약처가 제시한 개선방안은 ▲품질문서 영문자료 인정범위 확대 ▲임상시험계획 변경승인 불필요 사항 ▲임상시험용의약품 품질 변경 일괄적용 방법 등이다.
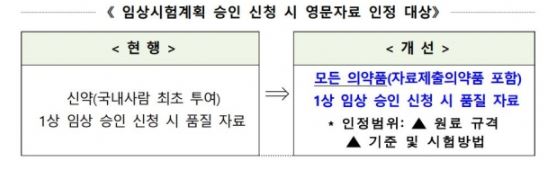
우선 '품질문서 영문자료 인정범위 확대'와 관련해서는 '국내 사람 최초투여' 신약 뿐아니라 자료제출의약품 등 모든 임상 1상 해외개발 의약품의 영문자료를 인정하기로 했다.<그림 참조>
구체적으로 현재 임상시험계획 승인 신청 시 영문자료 인정대상인 '신약(국내사람 최초신약) 1상 임상 승인 시 품질자료' 범위를 '모든 의약품(자료제출의약품 포함) 1상 임상 승인 신청 시 품질자료'로 확대한다는 내용이다.
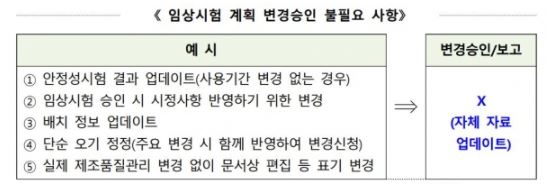
'임상시험계획 변경승인 불필요사항'은 품질 자료 중 변경승인대상이 아님에도 불구하고 불필요한 변경신청으로 임상시험이 지연될 것을 우려해 해당 내용을 업체가 자체 자료를 업데이트해 관리하도록 했다.
임상시험 계획 변경승인 불필요 사항은 ▲안정성시험 결과 업데이트(사용기간 변경없는 경우) ▲임상시험 승인 시 시정사항 반영하기 위한 변경 ▲배지 정보 업데이트 ▲단순 오기 정정(주요 변경 시 함께 반영해 변경신청) ▲실제 제조품질관리 변경없이 문서상 편집 등 표기 변경 등이다.<그림 참조>
이런 불필요한 사항을 식약처에 변경승인 등을 보고하지 않고 제약회사가 스스로 자료를 업테이트해 효율성을 높이라는 취지다.
'임상시험용의약품 품질 변경 일괄적용 방법'은 말그대로 제약회사가 동일한 임상시험용 의약품으로 다수의 임상시험을 진행하고 있을 때 동일한 변경사항을 각 임상시험계획서에 일괄 적용해 줄 것을 요청하면 식약처가 이를 반영해주는 조치다.
제약회사는 변경승인 신청 시 품질 변경 일괄 반영 요청 공문을 식약처에 제출하면 된다. 공문에는 임상시험승인번호, 일련번호, 계획서 명칭을 기재하면 된다. <그림 참조>
식약처 관계자는 "이같은 개선방안이 민원인인 제약회사의 편의를 증대시키는 한편, 민원업무의 예측성과 효율성을 높일 것으로 전망된다"고 밝혔다.


